二氧化硅(SiO2):无色或白色固体,不溶于水,熔点高,硬度大。SiO2俗称“硅石”,又称“硅土”,也叫硅酐。SiO2广泛存在于自然界中,构成了各种矿物和岩石。沙子、石英的主要成分就是SiO2。透明的石英晶体即水晶,水晶中的烟水晶和紫水晶经琢磨可做半宝石,薄片可做滤波器,抽成细丝可做光导纤维。自然界还有无定形的硅石,叫做硅藻土,常用作甘油炸药(硝化甘油)的吸附体。普通的沙子是制造玻璃、陶瓷、水泥和耐火材料等的原料。
二氧化碳(CO2):无色无味气体,密度比空气大,能溶于水,20℃时,1体积水约可溶解1体积CO2,与水可反应生成碳酸,称为“碳酸气”,是碳酸酐或碳酐。固态CO2俗称“干冰”。CO2被认为是造成温室效应的主要来源。CO2不能燃烧也不支持燃烧。CO2用于制汽水、温室肥料和灭火器,干冰做制冷剂等。
二氧化硫(SO2):无色有强烈刺激性气味的有毒气体,密度比空气大,易液化,易溶于水,常温常压下,1体积水约可溶解40体积SO2,与水可反应生成亚硫酸,是亚硫酐。化石燃料中含硫元素,燃烧后生成SO2会污染空气,SO2是大气主要污染物之一,又是造成酸雨的主要污染物之一。SO2可做纸浆、毛、丝、草编制品等的漂白剂和食品的防腐剂、消毒剂等。
二氧化氮(NO2):红棕色有强烈刺激性气味的有毒气体,密度比空气大,易溶于水且与水反应生成HNO3和NO,可与碱反应,但NO2是不成盐氧化物,不 是硝酸的酸酐。NO2主要来自高温燃烧过程的释放,比如机动车、电厂废气的排放等,NO2还是酸雨的成因之一。NO2在化学反应和火箭燃料中用作氧化剂,在亚硝基法生产硫酸中用作催化剂。
二氧化氯(ClO2):ClO2是一种黄绿色到橙红色有刺激性气味的气体,密度比空气大,易溶于水,见光易分解、易与碱反应,其杀菌漂白的能力远优于氯气,是国际上公认的含氯消毒剂中唯一的高效消毒灭菌剂,它可以杀灭一切微生物,消毒水体时不产生有害物质,是新一代的自来水消毒剂。ClO2具有除藻、剥泥、防腐、抗霉、保鲜、除臭、氯化及漂白色等多方面的功能,用途十分广泛。
二氧化锰(MnO2):黑色粉末,不溶于水和硝酸,具有氧化性,与浓盐酸共热放出Cl2。大量用于炼钢,并用于制玻璃、陶瓷、搪瓷、干电池以及用作催化剂等。
二氧化铅(PbO2):棕褐色结晶或粉末,不溶于水、醇,溶于乙酸、氢氧化钠水溶液。我国古代炼丹中经常使用到红丹,俗称铅丹。二氧化铅电极是良好的阳极材料,可代替铂阳极。
二氧化钛(TiO2):白色粉末,俗称钛白粉,又名“钛白”,是世界上最白的物质。二氧化钛在水中的溶解度很小,但可溶于酸,也可溶于碱。用于制涂改液、油漆和建筑业等。
非金属二氧化物的性质对比
1.物理性质:
①色、态、味:除SiO2外,其余均是气体;除NO2红棕色、ClO2黄绿色到橙红色外,其余均为无色;SO2、NO2、ClO2均有刺激性气味。
②毒性:除CO2、SiO2外,其余均有毒。
2.化学性质:
①SiO2、CO2、SO2均属于酸性氧化物,NO2、ClO2为不成盐氧化物,但它们均可与强碱溶液反应。
适量SiO2、CO2、SO2与强碱溶液反应均生成正盐和水,若与少量强碱溶液反应CO2、SO2可生成酸式盐:
SiO2+2NaOH==Na2SiO3+H2O
CO2+2NaOH==Na2CO3+H2O
CO2+NaOH==NaHCO3
SO2+2NaOH==Na2SO3+H2O
SO2+NaOH==NaHSO3
CO2+Ca(OH)2==CaCO3↓+H2O
2CO2+Ca(OH)2==Ca(HCO3)2
SO2+Ca(OH)2==CaSO3↓+H2O 2SO2+Ca(OH)2==Ca(HSO3)2
NO2、ClO2与强碱溶液发生歧化反应生成两种正盐和水:
2NO2+2NaOH==NaNO3+NaNO2+H2O 2ClO2+2NaOH==NaClO2+NaClO3+H2O
②除SiO2不溶于水与水不反应外,其余均与水反应:
CO2+H2O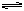 H2CO3 SO2+H2O
H2CO3 SO2+H2O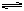 H2SO3
H2SO3
3NO2+H2O==2HNO3+NO 2ClO2+H2O==HClO2+HClO3
③SiO2、CO2、SO2与碱性氧化物反应生成含氧酸盐:
SiO2+CaO CaSiO3 CO2+CaO==CaCO3 SO2+CaO==CaSO3
CaSiO3 CO2+CaO==CaCO3 SO2+CaO==CaSO3
④与盐的反应主要体现在难挥发性酸酐制取易挥发性酸酐、二氧化物溶于水生成的相应酸较强制取较弱酸、二氧化物溶于水生成的相应酸与其正盐制取相应的酸式盐等三个方面:
SiO2+Na2CO3 Na2SiO3+CO2↑ SiO2+CaCO3
Na2SiO3+CO2↑ SiO2+CaCO3 CaSiO3+CO2↑
CaSiO3+CO2↑
CO2+Na2SiO3+H2O==H2SiO3↓+Na2CO3 CO2+Ca(ClO)2+H2O==CaCO3↓+2HClO
CO2+2Na[Al(OH)4]==2Al(OH)3↓+Na2CO3+H2O
CO2+C6H5ONa+H2O==C6H5OH↓+NaHCO3
2SO2+Na2CO3+H2O==2NaHSO3+CO2↑
SO2+Na2SiO3+H2O==H2SiO3↓+Na2SO3
SO2+Ca(ClO)2+H2O==CaSO4+HClO+HCl
(发生氧化还原反应)
SO2(过量)+H2O+C6H5ONa==C6H5OH↓+NaHSO3
SO2(少量)+H2O+2C6H5ONa==2C6H5OH↓+Na2SO3
2NO2+Na2CO3==NaNO2+NaNO3+CO2↑
2ClO2+Na2CO3==NaClO2+NaClO3+CO2↑
CO2+Na2CO3+H2O==2NaHCO3 SO2+Na2SO3+H2O==2NaHSO3
⑤氧化性主要体现在被碳单质、镁单质等还原:
SiO2+2C Si+2CO或SiO2+3C
Si+2CO或SiO2+3C SiC+2CO CO2+C
SiC+2CO CO2+C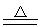 2CO
2CO
SO2+2C S+2CO或2SO2+5C
S+2CO或2SO2+5C CS2+4CO
CS2+4CO
2NO2+2C N2+2CO2或NO2+C
N2+2CO2或NO2+C NO+CO或2NO2+C
NO+CO或2NO2+C 2NO+CO2
2NO+CO2
CO2+2Mg 2MgO+C
2MgO+C
SiO2+2Mg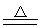 2MgO+Si或SiO2+4Mg
2MgO+Si或SiO2+4Mg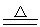 2MgO+Mg2Si
2MgO+Mg2Si
SO2+2Mg 2MgO+S或SO2+3Mg
2MgO+S或SO2+3Mg 2MgO+MgS
2MgO+MgS
2NO2+4Mg 4MgO+N2或2NO2+7Mg
4MgO+N2或2NO2+7Mg 4MgO+Mg3N2
4MgO+Mg3N2
SO2具有弱氧化性,只能与还原性强的氢硫酸反应:SO2+2H2S==3S↓+2H2O
NO2通常具有强氧化性,能与许多还原性物质反应,它能够将SO2、CO、KI、Cu等氧化:
NO2+SO2==NO+SO3 NO2+CO==NO+CO2
2NO2+2KI==I2+2KNO2 2NO2+4Cu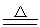 N2+4CuO
N2+4CuO
ClO2具有很强的氧化性,与很多物质能发生剧烈反应。它能够将Mn2+、Fe2+、S2-、CN-等氧化:
2ClO2+5Mn2++6H2O==5MnO2↓+12H++2Cl-
ClO2+5Fe2++4H+==Cl-+5Fe3++2H2O
8ClO2+5S2-+4H2O==5SO42-+8Cl-+8H+
2ClO2+2CN-==2CO2+N2+2Cl-
⑥还原性:
SO2具有较强的还原性,能被Cl2、Br2、I2、O2、KMnO4、FeCl3、H2O2、HNO3等氧化剂氧化为SO42-:
SO2+Cl2+2H2O==
H2SO4+2HCl SO2+Br2+2H2O==
H2SO4+2HBr
2SO2+O2 2SO3 5SO2+2KMnO4+2H2O==2MnSO4+K2SO4+2H2SO4
2SO3 5SO2+2KMnO4+2H2O==2MnSO4+K2SO4+2H2SO4
SO2+2FeCl3+2H2O==2FeCl2+H2SO4+2HCl SO2+H2O2==H2SO4
3SO2+2NaNO3+2H2O==Na2SO4+2NO↑+2H2SO4
NO2也显还原性:4NO2+O2+2H2O==4HNO3
⑦与过氧化钠反应:
2CO2+2Na2O2==2Na2CO3+O2(歧化反应,CO2既不显氧化性也不显还原性)
SO2+Na2O2==Na2SO4 (SO2显还原性)
2NO2+Na2O2==2NaNO3(NO2显还原性)
2ClO2+Na2O2==2NaClO2+O2(ClO2显氧化性)
⑧与氨气或氨水的反应:
CO2+NH3+H2O==NH4HCO3 SO2+NH3+H2O==NH4HSO3
6NO2+8NH3==7N2+12H2O
3.特性:
SiO2化学性质很稳定,不跟水或一般的酸反应,但能与氟化氢气体或氢氟酸反应生成四氟化硅气体:SiO2+4HF==SiF4↑+2H2O
SO2具有漂白性,可以使品红溶液褪色,加热后颜色还原。因为SO2的漂白原理是SO2与被漂白物反应生成无色的不稳定的化合物,加热时,该化合物分解,恢复原来颜色。
NO2很容易聚合,有平衡关系:2NO2N2O4+Q,故常温时,NO2中有一定量N2O4,而使实测的相对分子质量比由NO2化学式算出的数值稍大。
ClO2具有不稳定性,受热或遇光易分解成氧和氯,引起爆炸;遇到有机物等能促进氧化作用的物质时也可产生爆炸。
金属二氧化物的化学性质对比
①与浓硫酸反应:
2MnO2+2H2SO4(浓)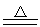 2MnSO4+O2↑+2H2O
2MnSO4+O2↑+2H2O
2PbO2+2H2SO4(浓)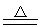 2PbSO4+O2↑+2H2O
2PbSO4+O2↑+2H2O
TiO2+2H2SO4(浓)==Ti(SO4)2+2H2O或TiO2+H2SO4(浓)==TiOSO4+H2O
②与强碱溶液反应:
MnO2+2NaOH==Na2MnO3(亚锰酸钠)
+H2O
PbO2+2NaOH==Na2PbO3+H2O
或PbO2+2NaOH
+2H2O==Na2[Pb(OH)6]
TiO2+2NaOH==Na2TiO3+H2O
③MnO2、PbO2可氧化浓盐酸:
MnO2+4HCl(浓)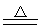 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
PbO2+4HCl(浓)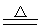 PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
④MnO2既显氧化性又显还原性:
3MnO2+4Al 3Mn+2Al2O3 MnO2+2C
3Mn+2Al2O3 MnO2+2C MnO+2CO
MnO+2CO
MnO2+H2 MnO+H2O MnO2+SO2
MnO+H2O MnO2+SO2 MnSO4
MnSO4
3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
MnO2+KNO3+K2CO3 K2MnO4+KNO2+CO2↑
K2MnO4+KNO2+CO2↑
⑤PbO2具有很强的氧化性,它能够将SO2、Fe2+、Mn2+、Cr3+等氧化:
PbO2+SO2==PbSO4
PbO2+
2Fe2++4H+==2Fe3++Pb2++2H2O
5PbO2+2Mn2++4H+==2MnO4-+5Pb2++2H2O
3PbO2+ 2Cr3++H2O
==Cr2O72-+3Pb2++2H+
PbO2受热分解可产生O2,所以它是生氧剂与一些可燃物一起摩擦可以产生火,应用于火柴的制造和野外生火用。
分解转化:PbO2→Pb12O19→Pb12O17→Pb3O4→PbO
⑥MnO2、PbO2可作为电池的正极材料:
普通锌锰电池(干电池)反应原理:
2MnO2+2Zn+4NH4Cl==[Zn(NH3)4]Cl2+ZnCl2+Mn2O3+H2O
铅蓄电池反应原理:
PbO2+Pb+2H2SO4==2PbSO4+2H2O
(责任编辑:化学自习室)


 CaSiO3
CaSiO3  Na2SiO3+CO2↑
Na2SiO3+CO2↑  CaSiO3+CO2↑
CaSiO3+CO2↑  Si+2CO或SiO2+3C
Si+2CO或SiO2+3C SiC+2CO
SiC+2CO  2CO
2CO N2+2CO2或NO2+C
N2+2CO2或NO2+C NO+CO或2NO2+C
NO+CO或2NO2+C 2NO+CO2
2NO+CO2 2MgO+Si或SiO2+4Mg
2MgO+Si或SiO2+4Mg 2MgO+Mg2Si
2MgO+Mg2Si 4MgO+N2或2NO2+7Mg
4MgO+N2或2NO2+7Mg 4MgO+Mg3N2
4MgO+Mg3N2 N2+4CuO
N2+4CuO  2SO3
2SO3  2MnSO4+O2↑+2H2O
2MnSO4+O2↑+2H2O 2PbSO4+O2↑+2H2O
2PbSO4+O2↑+2H2O 3Mn+2Al2O3
3Mn+2Al2O3  MnO+2CO
MnO+2CO 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O K2MnO4+KNO2+CO2↑
K2MnO4+KNO2+CO2↑
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。