
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、稀释前后质量分数与物质的量浓度之间的关系
例1、将质量分数为2![]() 、物质的量浓度为c1的硫酸溶液加水稀释,使质量分数变为
、物质的量浓度为c1的硫酸溶液加水稀释,使质量分数变为![]() ,物质的量浓度变为c2,则c1与c2的关系( )
,物质的量浓度变为c2,则c1与c2的关系( )
A、c1= 2c2 B、c1< 2c2 C、c1> 2c2 D、c2= 2c1
解析:此题可用质量分数与物质的量浓度的转化公式来计算,即:c =![]() 。设质量分数为2
。设质量分数为2![]() 的硫酸的密度为
的硫酸的密度为![]() ,物质的量浓度为c1,质量分数为
,物质的量浓度为c1,质量分数为![]() 的硫酸的密度为
的硫酸的密度为![]() ,物质的量浓度为c2,依题意:c1=
,物质的量浓度为c2,依题意:c1= ![]() ,c2=
,c2= ![]() 。
。
联立解得:![]() (由于
(由于![]() )故c1> 2c2。本题答案应选C。
)故c1> 2c2。本题答案应选C。
二、稀释中水的体积计算
例2、(1998年上海高考)在100g浓度为18 mol/L、密度为![]() (g/cm3)的浓硫酸中加入一定量的水稀释成9 mol/L的硫酸,则加入水的体积为( )
(g/cm3)的浓硫酸中加入一定量的水稀释成9 mol/L的硫酸,则加入水的体积为( )
A、小于100mL B、等于100mL C、大于100mL D、等于![]()
解析:本题的条件设置比较抽象,不但给出浓H2SO4的密度为字母,而且没有已知稀释后硫酸溶液的密度,故可设9 mol/L的硫酸的密度为![]() 。则根据硫酸稀释前后H2SO4的物质的量保持不变,即c1V1= c2V2可列方程:
。则根据硫酸稀释前后H2SO4的物质的量保持不变,即c1V1= c2V2可列方程:
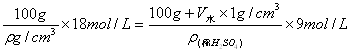 。
。
又因![]() >
> ![]() ,则有200 > 100 + V水,则V水< 100mL。本题答案应选A。
,则有200 > 100 + V水,则V水< 100mL。本题答案应选A。
三、两种不同浓度的硫酸等体积混合
例3、设90%的H2SO4溶液与10%的H2SO4溶液等体积混合,所得溶液的质量分数为( )
A、< 50% B、> 50% C、= 50% D、无法确定
解析:设90%的H2SO4溶液的密度为d1g/cm3,10%的H2SO4溶液的密度为d2g/cm3,体积均为V mL,则混合后溶液的质量分数为:
![]() (数学处理)
(数学处理)
=![]() 。
。
由于H2SO4溶液的密度大于1,故浓度越大,密度也越大(d1> d2),即d1– d2> 0,显而易见,混合后溶液的质量分数![]() > 50%。正确答案为B。
> 50%。正确答案为B。
若等质量混合,则混合后溶液的质量分数为(设两溶液质量均为m):
![]()
由此可总结出一条规律:
同一物质不同浓度的溶液混合,若浓溶液中溶质的质量分数为a%,稀溶液中溶质的质量分数为b%,且a% > b%,则有如下规律:
若两溶液等质量混合,混合后溶液中溶质的质量分数![]() ;
;
若两溶液等体积混合,且浓溶液的密度为d1,稀溶液的密度为d2,则有两种情况:
1、当溶液的密度大于1,即浓度越大,密度也越大,d1> d2,混合后溶液中溶质的质量分数> ![]() 。如:多数酸、碱、盐的浓、稀溶液等体积混合遵循此规律。
。如:多数酸、碱、盐的浓、稀溶液等体积混合遵循此规律。
2、当溶液的密度小于1,即浓度越大,密度越小,d1< d2,混合物后溶液中溶质的质量分数< ![]() 。如浓、稀氨水或酒精溶液等体积混合遵循此规律。
。如浓、稀氨水或酒精溶液等体积混合遵循此规律。
掌握了以上规律,同学们不妨练习以下几道考题:
1、(1997年全国高考)密度为0.91g·cm–3的氨水,质量分数为25%,该氨水用等体积的水稀释后,所得溶液溶质的质量分数是( )
A、等于12.5% B、大于12.5% C、小于12.5% D、无法确定
2、(1999年全国高考)已知25%的氨水的密度为0.91g·cm–3,5%的氨水的密度为0.98g·cm–3,若将上述两溶液等体积混合,所得氨水的溶液的质量分数是( )
A、等于15% B、小于15% C、大于15% D、无法估算
3、某物质一定量的溶液,其质量分数为0.2a。当加入等体积的水稀释后,其质量分数小于0.1a。则原溶液的密度为( )
A、大于水的密度 B、小于水的密度 C、等于水的密度 D、无法确定
4、浓度不等的两种硫酸溶液等质量混合时,其质量分数为a%,而等体积混合时浓度为b%;浓度不等的两种乙醇溶液等质量混合时,其质量分数也为a%,而等体积混合时浓度为c%,则a、b、c间的大小关系为( )
A、a > b > c B、b > a > c C、c > a > b D、不可比较
5、将p%的浓硫酸与同体积的水混合,得到q%的稀硫酸,则p、q的关系正确的是( )
A、p ≤q B、p = 2q C、p > 2q D、p < 2q
答案:1、简析:用水稀释相当于加入溶质质量分数为0的氨水,依据上述规律,易知选C。
2、B.
3、B.
4、简析:设硫酸浓度分别为A%和B%,
等质量混合时:![]() ,等体积混合时:b% >
,等体积混合时:b% > ![]() ,故b > a;
,故b > a;
设乙醇浓度分别为C%和D%,
等质量混合时:![]() ,等体积混合时:c% <
,等体积混合时:c% < ![]() ,故a > c;
,故a > c;
由上分析可知:b > a > c,所以答案为B。
5、简析:水可以看作0%的硫酸。故利用上述规律可得:q% > ![]() ,即p < 2q。所以应选D。
,即p < 2q。所以应选D。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。陷阱1、物质的状态。 命题中常涉及物质的体积,需考虑是否为气体。 例如,标准状况下H...
类型一关于气体的摩尔体积 解题策略:有体积,无标况或非气态,均不能计算 注意:CCl ...
化学式子要配平,必须纯量代方程, 单位上下要统一,左右倍数要相等。 质量单位若用克...
1.化学方程式不正确就计算,这是最严重的问题. 2.把含杂质的质量直接应用在化学方程式...
有关阿伏伽德罗常数(N A )的计算是高考化学命题的一大热点,让考生对有关阿伏伽德罗...
一、高考定位 通过分析近几年的全国卷真题可知,该类试题多是通过阿伏加德罗常数将化...