
|
学习小专题 |

|
学习小专题 |
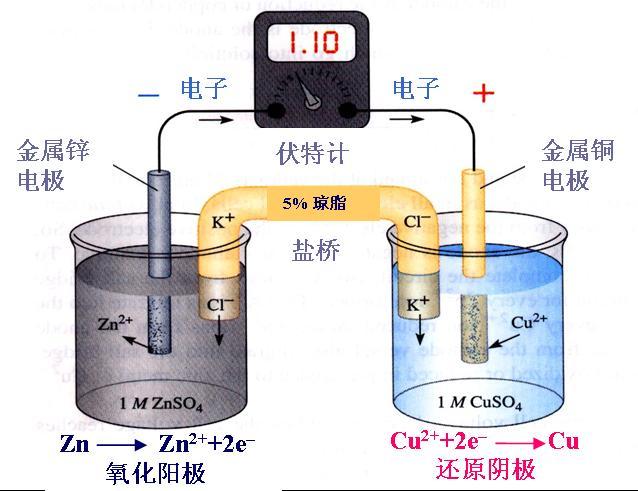 [元素化合物] 一些化学物质的俗名及用途 作者:陈螯 来源:未知 日期:2023-08-12 09:26:01 点击:3129 所属专题:俗名
[元素化合物] 一些化学物质的俗名及用途 作者:陈螯 来源:未知 日期:2023-08-12 09:26:01 点击:3129 所属专题:俗名
各种剂 1.氧化剂 指得到电子的物质。中学化学中的氧化剂有:Cl 2 、KMnO 4 、浓H 2 SO 4 、HNO 3 、FeCl 3 等。 2.还原剂 指失去电子的物质。中学化学中的还原剂有:Na、Al、Zn、CO、C等。 3.干燥剂 指能从大气中吸收潮气同时与水化合的一种媒介。中学化学中的干燥剂...
 [元素化合物] 难写的化学方程式归纳总结 作者:张超鹏 来源:未知 日期:2020-03-19 13:40:19 点击:3291 所属专题:化学方程式 陌生方程式
[元素化合物] 难写的化学方程式归纳总结 作者:张超鹏 来源:未知 日期:2020-03-19 13:40:19 点击:3291 所属专题:化学方程式 陌生方程式
一.非氧化还原反应 1.若实验室用CaO和碳铵作原料制取氨气,用一个化学方程式表示反应原理。 [解析]NH 4 HCO 3 热分解的产物是NH 3 、CO 2 和H 2 O,CaO既吸收CO 2 又吸收H 2 O。 NH 4 HCO 3 +2CaO=NH 3 ↑+CaCO 3 +Ca(OH) 2 2.“在溶液中发生的离子互换反应一般...
 [元素化合物] 中学化学中有关银的知识 作者:杨帆 来源:山西省壶关第一中学 日期:2016-01-18 16:42:50 点击:7296 所属专题:银
[元素化合物] 中学化学中有关银的知识 作者:杨帆 来源:山西省壶关第一中学 日期:2016-01-18 16:42:50 点击:7296 所属专题:银
银及其化合物的一些知识是中学化学元素化合物内容的有机组成部分,但在教材中这部分内容散而乱,为此笔者从性质和用途等方面对这部分知识简单概括。 一、单质 单质银是银白色金属,密度10.5g/cm 3 ,熔点962℃,硬度2.5-4,延展性仅次于金,导电传热性在所有金属中最好...
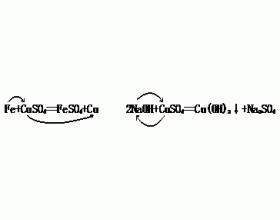 [方法与规律2] 酸碱盐学习中的“12345” 作者:王兵 来源:江苏省邳州市运河中学 日期:2016-01-17 14:32:58 点击:2030 所属专题:酸碱盐
[方法与规律2] 酸碱盐学习中的“12345” 作者:王兵 来源:江苏省邳州市运河中学 日期:2016-01-17 14:32:58 点击:2030 所属专题:酸碱盐
摘要:一个原则─-交换的原则,1个规律─-“成盐”的规律;两类反应条件─-置换反应和复分解反应的条件;三类物质的性质─-根据成盐规律可推出酸、碱、盐的化学性质;四类能溶于水的物质─-钾、钠、铵、硝的化合物;五类物质─-单质、氧化物、酸、碱、盐的相互关系。 又...
 [元素化合物] 解读十类化学反应先后顺序 作者:赵亭 来源:重庆市暨华中学 日期:2022-08-11 16:18:20 点击:16383 所属专题:反应先后 化学反应
[元素化合物] 解读十类化学反应先后顺序 作者:赵亭 来源:重庆市暨华中学 日期:2022-08-11 16:18:20 点击:16383 所属专题:反应先后 化学反应
· 现行中学教材中 , 涉及到十种类型的反应需要考虑到试剂反应的先后顺序 ,现列举如下 。 1 、酸性不同的酸遇同一种碱 当同一溶液中存在多种酸时,若向此溶液中逐滴加入一种碱液时,一般来说,碱先与酸性强的酸反应,然后与酸性较弱的酸的反应。如向盐酸和醋酸的混合溶...
 [元素化合物] 常见金属及其化合物的性质知识要点 作者:欧阳文兵 来源:未知 日期:2016-01-09 17:46:59 点击:7349 所属专题:金属及其化合物
[元素化合物] 常见金属及其化合物的性质知识要点 作者:欧阳文兵 来源:未知 日期:2016-01-09 17:46:59 点击:7349 所属专题:金属及其化合物
一、钠及其化合物 1. 钠与酸反应时,先于酸反应,酸不足再与水反应。 2. 钠与盐的溶液时,钠不能置换出溶液中的金属,是钠直接与水反应,反应后生成的碱再与溶液中的物质反应。 3. 等物质的量的金属钠与氧气作用生成 Na 2 O 和 Na 2 O 2 时,转移的电子数相同。 4.Na 2 ...
 [元素化合物] 中学化学中密度的七点应用 作者:关平 来源:未知 日期:2016-01-29 19:44:33 点击:13169 所属专题:密度
[元素化合物] 中学化学中密度的七点应用 作者:关平 来源:未知 日期:2016-01-29 19:44:33 点击:13169 所属专题:密度
应用一:实验室收集气体时的考虑气体的密度。 1 、标准状况下,气体的密度 = ,气体的密度单位: g/L 。 2 、标准状况下比较密度就是比较气体的摩尔质量,气体的摩尔质量在数值上与气体的相对分子质量相等,空气的平均相对分子质量为 29 。 3 、相对分子质量比 29 小且...
 [元素化合物] 常见混合气的主要成分比较 作者:方丽妹 来源:未知 日期:2016-01-07 12:29:27 点击:3946 所属专题:常见气体
[元素化合物] 常见混合气的主要成分比较 作者:方丽妹 来源:未知 日期:2016-01-07 12:29:27 点击:3946 所属专题:常见气体
名 称 来 历 主要成分 主要用途 天然气 蕴藏在地层内的一种可燃性气体 低式量的烃的混和物,主要有CH4、C2H6等 燃料、制炭黑、合成石油 水煤气 水蒸气通过灼热的碳层 C+H2O(g)→ H2+CO CO 40%,H2 50%,CO2、N2、CH4共10% 燃料,合成NH3 发生炉煤气 将限量的空气通过赤...
 [元素化合物] 如何比较物质的热稳定性? 作者:许浩年 来源:未知 日期:2016-01-18 09:55:31 点击:24190 所属专题:稳定性
[元素化合物] 如何比较物质的热稳定性? 作者:许浩年 来源:未知 日期:2016-01-18 09:55:31 点击:24190 所属专题:稳定性
1、单质的热稳定性与键能的相关规律一般说来,单质的热稳定性与构成单质的化学键牢固程度正相关;而化学键牢固程度又与键能正相关。 2、气态氢化物的热稳定性:元素的非金属性越强,形成的气态氢化物就越稳定。同主族的非金属元素,从上到下,随核电荷数的增加,非金属...
 [元素化合物] 有关“水”的知识总结 作者:张安荣 来源:未知 日期:2016-01-07 16:38:28 点击:7337 所属专题:纯水
[元素化合物] 有关“水”的知识总结 作者:张安荣 来源:未知 日期:2016-01-07 16:38:28 点击:7337 所属专题:纯水
1.水在氧化还原反应中的作用 (1)、水作氧化剂 水与钠、其它碱金属、镁等金属反应生成氢气和相应碱 水与铁在高温下反应生成氢气和铁的氧化物(四氧化三铁): 水与碳在高温下反应生成“水煤气”: 铝与强碱溶液反应: (2)、水做还原剂 水与F 2 的反应: (3)、水既做氧化...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【导读】“强酸制弱酸”是复分解反应的常见规律,其本质是强酸电离出的H更易与弱酸根...
在高中化学中,很多同学从初中就学习了复分解反应, 都知道复分解反应中“强酸制弱酸...
1.水银:汞Hg 2.过氧一硫酸:过氧硫酸过硫酸 H 2 SO 5 3.白金:主要成分铂 Pt 4.苯:C...
...
元素种类 对应物质的常考易错点 N 性质:(1)浓HNO 3 和Cu(足量)在反应时,随反应进行...
例题1:浓硫酸与金属反应的条件 题目:常温下,浓硫酸能否与金属铁发生反应? 错误答...
鲍林在研究含氧酸时,将其化学式一般写作 HRO,其中 R 代表中心原子,羟基(–OH)与...
...