
|
学习小专题 |

|
学习小专题 |
 [元素化合物] 中学化学中常见酸的特殊性质归纳 作者:李留记 来源:未知 日期:2016-01-07 12:48:36 点击:12433 所属专题:常见酸 一般与特殊 反常
[元素化合物] 中学化学中常见酸的特殊性质归纳 作者:李留记 来源:未知 日期:2016-01-07 12:48:36 点击:12433 所属专题:常见酸 一般与特殊 反常
1 、不稳定性酸 这部分酸包括 H 2 CO 3 、 H 2 SO 3 、 HClO 、 HNO 3 (浓)、 H 4 SiO 4 、氢硫酸( H 2 S )、氢碘酸( HI )、氢硒酸( H 2 Se )、氢碲酸( H 2 Te )等。 ( 1 )常温(或微热)易分解的酸: H 2 CO 3 、 H 2 SO 3 、 HNO 3 (浓)、 H 4 SiO 4 等...
 [元素化合物] 剖析金属活动性顺序表在中学化学中的运用 作者:张红 来源:未知 日期:2016-01-18 16:19:59 点击:16266 所属专题:金属活动性顺序表
[元素化合物] 剖析金属活动性顺序表在中学化学中的运用 作者:张红 来源:未知 日期:2016-01-18 16:19:59 点击:16266 所属专题:金属活动性顺序表
一、金属活动性顺序表的发现 1865年,俄国学者贝开托夫(Beketob)在实验的基础上,研究了金属单质与水、酸及盐溶液间进行置换反应的速度,发表了《对某一元素为另一元素所置换的研究》论文,总结出金属活动性顺序为: K Na Ca Mg Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 在这...
 [元素化合物] 利用配平诗集配平 作者:刘明 来源:未知 日期:2012-05-09 21:53:35 点击:33784 所属专题:化学方程式配平
[元素化合物] 利用配平诗集配平 作者:刘明 来源:未知 日期:2012-05-09 21:53:35 点击:33784 所属专题:化学方程式配平
这部分诗包括六首小诗,前五首向你介绍了化学反应方程式的五种配平方法,第六首诗告诉你在实际配平过程中,如何灵活巧妙地运用这五种方法。如果你能记住并理解这六首小诗,那么你就可以自豪地说:“世界上没有一个化学反应方程式我不会配平……” 歧化反应的简捷配平法 三种...
 [元素化合物] 话说酸的“六个”不一定 作者:陈恒 来源:未知 日期:2021-10-12 15:00:47 点击:5192 所属专题:常见酸 是非判断
[元素化合物] 话说酸的“六个”不一定 作者:陈恒 来源:未知 日期:2021-10-12 15:00:47 点击:5192 所属专题:常见酸 是非判断
㈠.名称叫酸的物质不一定是酸。 例如:石炭酸(苯酚),虽然它显示出了一定的弱酸性,但是它仍然属于酚而不属于酸。 ㈡.无氧酸不一定是非金属元素的氢化物的水化物。 例如:氢氰酸(HCN)。 ㈢.酸的元数不一定等于其分子中的H原子数。 例如:亚磷酸(H 3 PO 3 )是二元...
 [元素化合物] 常见的物质颜色 作者:王瑜 来源:未知 日期:2012-03-27 09:08:52 点击:12250 所属专题:物质颜色
[元素化合物] 常见的物质颜色 作者:王瑜 来源:未知 日期:2012-03-27 09:08:52 点击:12250 所属专题:物质颜色
一. 常见的物质颜色 1. 红色 部分含三价铁的化合物:Fe(OH) 3 红褐色(胶体或沉淀), 血红色溶液,Fe 2 O 3 红棕色粉末,Fe 2 O 3 ·nH 2 O(铁锈)红棕色固体。 液Br 2 为深红棕色液体,Br 2 蒸气和NO 2 为红棕色气体。红磷为红棕色固体,苯酚在空气中久置变为粉红色。 2....
 [元素化合物] 条件不同 产物各异 作者:田兴虎 来源:未知 日期:2016-03-09 18:37:55 点击:18824 所属专题:条件与产物
[元素化合物] 条件不同 产物各异 作者:田兴虎 来源:未知 日期:2016-03-09 18:37:55 点击:18824 所属专题:条件与产物
在化学反应过程中,由于反应条件、反应物的物质的量不同等原因,往往使反应进程发生改变,导致反应生成物的不同。中学化学中涉及到的这类反应很多,学习、掌握和运用这些反应,不仅可以深刻理解化学反应实质,且有利于培养严谨的科学态度,使知识得以升华。 一、反应物...
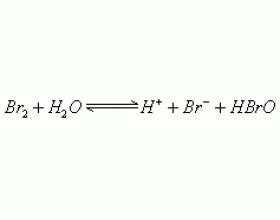 [元素化合物] 使溴水褪色的物质 作者:刘丽颖 来源:未知 日期:2013-03-28 10:27:04 点击:13031 所属专题:溴水
[元素化合物] 使溴水褪色的物质 作者:刘丽颖 来源:未知 日期:2013-03-28 10:27:04 点击:13031 所属专题:溴水
红棕色的单质 溴 溶于 水得到 的混合物俗称溴水,溶于水的 溴只有 少量与水反应。在溴水中存在如下平衡: 溴水中存在三种分子,四种离子,但由于这一反应趋势很小,因此在溴水中 溴主要 以分子形式存在。溴水的颜色由于溶有 溴 单质而呈现橙色。溴水是中学阶段常用于物...
 [元素化合物] 如何正确书写无机化学反应方程式 作者:章金莲 来源:未知 日期:2016-01-17 20:58:27 点击:8011 所属专题:化学方程式
[元素化合物] 如何正确书写无机化学反应方程式 作者:章金莲 来源:未知 日期:2016-01-17 20:58:27 点击:8011 所属专题:化学方程式
化学反应方程式是中学化学基础知识的重要组成部分,只要我们认真分析高中涉及到和高考中所考查的化学反应方程式,就会发现其中蕴涵的规律,下面就如何正确书写无机化学反应方程式谈几点做法。 一、把握高中最重要的两种反应类型 1.复分解反应(以广义酸、碱之间的中和反...
 [元素化合物] 每种酸的特点小结 作者:汪峰 来源:未知 日期:2012-03-06 15:15:00 点击:12438 所属专题:常见酸
[元素化合物] 每种酸的特点小结 作者:汪峰 来源:未知 日期:2012-03-06 15:15:00 点击:12438 所属专题:常见酸
(1)氢氟酸是一种可以腐蚀玻璃的一元弱酸(离子方程式中HF应写成分子式,氟化钠溶液显碱性,请用离子方程式表示其原因),氟化氢分子间因形成氢键而使得它的沸点在卤化氢中最高。 (2)盐酸是一种一元强酸,浓盐酸具有挥发性(瓶口有白雾)、还原性(加热时可以被二氧化锰氧化...
 [元素化合物] 高中无机反应类比失误的教训 作者:汤芹 来源:未知 日期:2012-03-05 18:14:04 点击:14216 所属专题:信息题 类比
[元素化合物] 高中无机反应类比失误的教训 作者:汤芹 来源:未知 日期:2012-03-05 18:14:04 点击:14216 所属专题:信息题 类比
1.金属铁投入硫酸铜溶液发生置换反应有铜析出:Fe+CuSO 4 ===Cu+FeSO 4 类比失误:金属钠投入硫酸铜溶液发生置换反应有铜析出:2Na+CuSO 4 ===Cu+Na 2 SO 4 失误原因: Cu 2+ 的氧化性强于H + ,但Cu 2+ 与金属钠的反应速率远小于水与金属钠的反应速率,故金属钠投入硫酸铜...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【导读】“强酸制弱酸”是复分解反应的常见规律,其本质是强酸电离出的H更易与弱酸根...
在高中化学中,很多同学从初中就学习了复分解反应, 都知道复分解反应中“强酸制弱酸...
1.水银:汞Hg 2.过氧一硫酸:过氧硫酸过硫酸 H 2 SO 5 3.白金:主要成分铂 Pt 4.苯:C...
...
元素种类 对应物质的常考易错点 N 性质:(1)浓HNO 3 和Cu(足量)在反应时,随反应进行...
例题1:浓硫酸与金属反应的条件 题目:常温下,浓硫酸能否与金属铁发生反应? 错误答...
鲍林在研究含氧酸时,将其化学式一般写作 HRO,其中 R 代表中心原子,羟基(–OH)与...
...