
|
学习小专题 |

|
学习小专题 |
 [元素化合物] 化学反应的类比迁移18例 作者:张安荣 来源:未知 日期:2022-08-11 16:27:04 点击:17527 所属专题:化学反应 类比
[元素化合物] 化学反应的类比迁移18例 作者:张安荣 来源:未知 日期:2022-08-11 16:27:04 点击:17527 所属专题:化学反应 类比
类比思维能帮助我们认识一类本质相似的问题,找出物质变化遵循的共同规律,是利用“已知”解决“未知”的一种有效策略,达到举一反三、触类旁通、以点带面、事半功倍的学习效果。现将中学化学中可类比的部分物质性质举例如下。 1.H 2 O与NH 3 类比 电离:2H 2 O H 3 O ...
 [元素化合物] 中学化学中硫酸的作用 作者:张扬 来源:未知 日期:2016-06-01 15:32:21 点击:12630 所属专题:硫酸作用
[元素化合物] 中学化学中硫酸的作用 作者:张扬 来源:未知 日期:2016-06-01 15:32:21 点击:12630 所属专题:硫酸作用
一、制取许多气体的重要试剂 1.制H 2 (利用硫酸的酸性或H + 离子的氧化性): Zn+H 2 SO 4 (稀)==ZnSO 4 +H 2 ↑;Fe+H 2 SO 4 (稀)==FeSO 4 +H 2 ↑ 2.制SO 2 (①利用硫酸的酸性;②利用硫酸的强氧化性和酸性): ①Na 2 SO 3 +H 2 SO 4 (中等浓度)==Na 2 SO 4 +...
 [元素化合物] 中学化学中氢氧化钠的作用 作者:张楠 来源:未知 日期:2023-03-02 10:37:44 点击:26630 所属专题:氢氧化钠
[元素化合物] 中学化学中氢氧化钠的作用 作者:张楠 来源:未知 日期:2023-03-02 10:37:44 点击:26630 所属专题:氢氧化钠
氢氧化钠是学生从初中开始学习化学时就接触到的强碱性物质,它在整个高中学习中有着极其重要的作用,广泛用于各种生产生活过程和化学解题过程中。如果能熟练地运用氢氧化钠的性质,将整个高中的知识贯穿起来,使其成为联系各类物质的纽带,那么,以氢氧化钠为主体的完整...
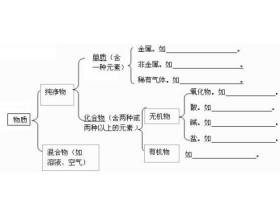 [注解与辨疑2] 酸碱盐知识归纳 作者:孙法军 来源:未知 日期:2016-01-17 15:01:05 点击:15499 所属专题:物质分类 酸碱盐
[注解与辨疑2] 酸碱盐知识归纳 作者:孙法军 来源:未知 日期:2016-01-17 15:01:05 点击:15499 所属专题:物质分类 酸碱盐
一 、酸、碱、盐的概念 物质 酸 碱 盐 概念 电离时解离出的阳离子全部是 氢离子 的化合物 电离时解离出的阴离子全部是 氢氧根 离子的化合物 由金属阳离子(或NH 4 + )和酸根阴离子组成的化合物 形式 酸 = H + + 酸根阴离子 碱 = 金属阳离子+OH - 盐=金属阳离子+酸根阴...
 [元素化合物] 常见的既能与酸又能与碱反应的物质 作者:章文 来源:未知 日期:2012-03-02 09:39:38 点击:3531 所属专题:两性物质
[元素化合物] 常见的既能与酸又能与碱反应的物质 作者:章文 来源:未知 日期:2012-03-02 09:39:38 点击:3531 所属专题:两性物质
⑴金属:Al、Zn ⑵非金属:Si(Si +3HCl SiHCl 3 +H 2 ↑) S(3S+6NaOH 2Na 2 S+Na 2 SO 3 +3H 2 O) ⑶两性氧化物:Al 2 O 3 、ZnO ⑷两性氢氧化物:Al(OH) 3 、Zn(OH) 2 ⑸弱酸的铵盐:(NH 4 ) 2 S、(NH 4 ) 2 SO 3 、CH 3 COONH 4 ⑹弱酸的酸式盐:NaHCO 3 、NaHS...
 [元素化合物] 金属活动性顺序在化学反应中的应用 作者:黄晓东 来源:未知 日期:2012-03-02 09:50:07 点击:12908 所属专题:金属活动顺序表
[元素化合物] 金属活动性顺序在化学反应中的应用 作者:黄晓东 来源:未知 日期:2012-03-02 09:50:07 点击:12908 所属专题:金属活动顺序表
⑴金属与酸反应:K Ca Na Mg A l Zn Fe Sn Pb (H) Cu Hg Ag Pt Au a、氢以前的金属能置换非氧化性酸中的氢:2Al+3H 2 SO 4 =Al 2 (SO 4 ) 3 +3H 2 ↑ b、氢以后的金属不能跟非氧化酸反应。只能与强氧化性酸反应: 3Cu+8HNO 3 (稀)=3Cu(NO 3 ) 2 +2NO↑+4H 2 O ...
 [元素化合物] 金属与酸反应的几种情况 作者:吴旭东 来源:未知 日期:2015-09-15 09:20:19 点击:8228 所属专题:金属与酸
[元素化合物] 金属与酸反应的几种情况 作者:吴旭东 来源:未知 日期:2015-09-15 09:20:19 点击:8228 所属专题:金属与酸
1.氢之前的金属能置换非氧化性酸的氢(Fe只能被H + 离子氧化生成Fe 2+ ) Fe + 2HBr == FeBr 2 + H 2 2.金属与氧化性酸的反应,一般没有H 2 生成,而是被成酸元素氧化 (1)Fe和Al被冷的浓HNO 3 和浓H 2 SO 4 钝化。(在金属表面生成致密的氧化物薄膜,阻止里面的金属...
 [元素化合物] 中学化学物质俗名一览表 作者:汤芹 来源:未知 日期:2011-08-29 22:41:31 点击:45935 所属专题:俗名
[元素化合物] 中学化学物质俗名一览表 作者:汤芹 来源:未知 日期:2011-08-29 22:41:31 点击:45935 所属专题:俗名
俗 名 化 学 名 称 主要成分化学式或结构简式 1、Na 纯碱(苏打) 碳酸钠 Na 2 CO 3 口碱 十水合碳酸钠 Na 2 CO 3 10H 2 O *山奈 氰化钠 NaCN 食盐 氯化钠 NaCl 保险粉 连二亚硫酸钠 Na 2 S 2 O 4 元明粉 硫酸钠 Na 2 SO 4 芒硝(朴硝) 十水合硫酸钠 Na 2 SO 4 10H 2 O 小...
 [元素化合物] 物质的俗称 作者:熊振典 来源:未知 日期:2016-01-07 13:48:49 点击:20810 所属专题:俗名
[元素化合物] 物质的俗称 作者:熊振典 来源:未知 日期:2016-01-07 13:48:49 点击:20810 所属专题:俗名
俗称 成分 俗称 成分 硫酸盐 胆矾或蓝矾 CuSO 4 5H 2 O 皓矾 ZuSO 4 7H 2 O 绿矾 FeSO 4 7H 2 O 芒硝 Na 2 SO 4 10H 2 O 重晶石或钡餐 BaSO 4 明矾 KAl(SO 4 ) 2 12H 2 O 生石膏 CaSO 4 2H 2 O 熟石膏 2CaSO 4 H 2 O 泻盐 MgSO 4 7H 2 O 矿石 斜体部分 仅供参考 萤石 Ca...
 [元素化合物] 物质的物理性质反常 作者:黄贞帧 来源:未知 日期:2015-12-23 17:39:36 点击:9928 所属专题:物理性质 反常 一般与特殊
[元素化合物] 物质的物理性质反常 作者:黄贞帧 来源:未知 日期:2015-12-23 17:39:36 点击:9928 所属专题:物理性质 反常 一般与特殊
(1)物质熔点反常 VA主族的 元素 中,从上至下,单质的熔点有升高的趋势,但铋的熔点比锑低;IVA主族的元素中,锡铅的熔点反常; 常温下三种物质(汞、钾钠合金、水)的状态反常。过渡元素 金属 单质通常熔点较高,而Hg在常温下是液态,是所有金属中熔点最低的。合金通...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【导读】“强酸制弱酸”是复分解反应的常见规律,其本质是强酸电离出的H更易与弱酸根...
在高中化学中,很多同学从初中就学习了复分解反应, 都知道复分解反应中“强酸制弱酸...
1.水银:汞Hg 2.过氧一硫酸:过氧硫酸过硫酸 H 2 SO 5 3.白金:主要成分铂 Pt 4.苯:C...
...
元素种类 对应物质的常考易错点 N 性质:(1)浓HNO 3 和Cu(足量)在反应时,随反应进行...
例题1:浓硫酸与金属反应的条件 题目:常温下,浓硫酸能否与金属铁发生反应? 错误答...
鲍林在研究含氧酸时,将其化学式一般写作 HRO,其中 R 代表中心原子,羟基(–OH)与...
...