
|
学习小专题 |

|
学习小专题 |
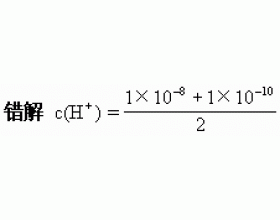 [注解与辨疑j] pH拾零 作者:潘祥泰 来源:未知 日期:2016-02-02 19:49:52 点击:9041 所属专题:ph值 ph计算
[注解与辨疑j] pH拾零 作者:潘祥泰 来源:未知 日期:2016-02-02 19:49:52 点击:9041 所属专题:ph值 ph计算
一、pH与酸碱性 1.溶液酸碱性的强弱由pH决定,与温度、溶质无关。如:pH均为2的硫酸溶液与醋酸溶液酸度相同。 2.pH等于7的溶液不一定呈中性。(“pH=7为中性”习惯上指常温时) 二、 pH的计算 1.计算时先确定溶液的酸碱性,计算顺序为:酸性→c(H + )→pH;碱性→c(O...
 [注解与辨疑j] 为什么要引入“pH” 作者:罗翊轩 来源:未知 日期:2016-03-09 21:47:08 点击:3148 所属专题:ph值
[注解与辨疑j] 为什么要引入“pH” 作者:罗翊轩 来源:未知 日期:2016-03-09 21:47:08 点击:3148 所属专题:ph值
溶液的酸碱度,可用[H + ]或[OH - ]表示。但我们常碰到的某些溶液的酸度或碱度很...
 [注解与辨疑j] 小议强酸和弱酸的区别 作者:熊振典 来源:未知 日期:2012-05-15 18:31:07 点击:7305 所属专题:强酸与弱酸比较
[注解与辨疑j] 小议强酸和弱酸的区别 作者:熊振典 来源:未知 日期:2012-05-15 18:31:07 点击:7305 所属专题:强酸与弱酸比较
1强酸在水溶液中全部电离,不存在溶质分子;弱酸在水溶液中部分电离,因存在电离平衡,所以既含溶质离子,又含溶质分子. 2 pH相同的强酸和弱酸,弱酸的物质的量浓度大于强酸的. 3同温度、同浓度的强酸溶液的导电性强于弱酸溶液的. 4中和同体积、同pH的强酸和弱酸,弱酸的...
 [注解与辨疑j] 纯水的电离度是多大? 作者:刘学超 来源:未知 日期:2012-05-15 18:26:17 点击:7757 所属专题:水的电离 电离度
[注解与辨疑j] 纯水的电离度是多大? 作者:刘学超 来源:未知 日期:2012-05-15 18:26:17 点击:7757 所属专题:水的电离 电离度
生活中,我们一般会认为纯水是不导电的。但根据精确的实验证明,水是一种极弱的电解质,它能微弱地电离,生成水合氢离子和氢氧根离子。其电离方程式可表示为: H 2 O+H 2 O H 3 O + +OH - 可简写为:H 2 O H + +OH - ,从纯水的导电实验测得,在25℃(常温)时,纯水中H + 和...
 [注解与辨疑j] 酸碱中和反应三种终点的比较 作者:翟娜 来源:未知 日期:2016-02-02 20:25:30 点击:14577 所属专题:中和滴定
[注解与辨疑j] 酸碱中和反应三种终点的比较 作者:翟娜 来源:未知 日期:2016-02-02 20:25:30 点击:14577 所属专题:中和滴定
酸碱中和反应的终点在理论上应是酸碱恰好完全反应的点(即化学反应的计量点)。但在中和滴定实验中,被滴定的溶液通常不发生任何外观变化,需要借助酸碱指示剂的颜色变化来指示滴定的终点。另外有时还会提出中和至中性的点。上述三种终点之间的区别和联系,我们在学习时...
 [注解与辨疑j] 透析电解质中的八大关系 作者:舒龙昌 来源:未知 日期:2016-02-02 20:34:29 点击:31817 所属专题:电解质判断 弱电解质判断
[注解与辨疑j] 透析电解质中的八大关系 作者:舒龙昌 来源:未知 日期:2016-02-02 20:34:29 点击:31817 所属专题:电解质判断 弱电解质判断
一.电解质、非电解质概念间的关系 电解质是指在水溶液中或熔化状态下能够导电的化合物;非电解质是指在水溶液中和熔化状态下都不能够导电的化合物。显然电解质和非电解质是对化合物的一种分类,因此混合物既不是电解质也不是非电解质。此外“不是电解质”与非电解质不...
 [注解与辨疑j] 强电解质和弱电解质怎么分? 作者:黄元 来源:未知 日期:2014-11-25 10:37:37 点击:5066 所属专题:弱电解质判断
[注解与辨疑j] 强电解质和弱电解质怎么分? 作者:黄元 来源:未知 日期:2014-11-25 10:37:37 点击:5066 所属专题:弱电解质判断
在水溶液中全部电离的电解质叫做强电解质,部分电离的电解质叫做弱电解质。 强酸、强碱和绝大多数可溶性的盐在水溶液里都能全部电离,它们都是强电解质。弱酸、弱碱在水溶液里只能部分电离,它们都是弱电解质。 从化合物结构来看,有典型离子键的化合物(如强碱和大部分...
 [注解与辨疑j] 同离子效应 作者:黄元 来源:未知 日期:2016-02-02 20:47:55 点击:8480 所属专题:同离子效应
[注解与辨疑j] 同离子效应 作者:黄元 来源:未知 日期:2016-02-02 20:47:55 点击:8480 所属专题:同离子效应
由于加入含相同离子的强电解质,使弱电解质电离度减小或使难溶盐溶解度降低的效应,叫同离子效应。分别说明如下: ①使弱电解质电离度减小 例如,在醋酸溶液中加人醋酸钠,由于醋酸钠是强电解质、在水中全部电离成Na + 和Ac - ,溶液中Ac - 浓度增大,大量的Ac - 同H + ...
 [注解与辨疑j] 盐效应 作者:许雁祥 来源:未知 日期:2012-03-12 19:28:47 点击:12544 所属专题:盐效应
[注解与辨疑j] 盐效应 作者:许雁祥 来源:未知 日期:2012-03-12 19:28:47 点击:12544 所属专题:盐效应
在弱电解质溶液中,如加入其他强电解质盐时,则该弱电解质的电离度将会增大。例如在 0 . 1 mol/L HAc 溶液中,加入 0 . 1 mol/L NaCl 则 c ( H + )不再是 1 . 33 × 10 -3 mol/L ,而是 1 . 68 × 10 -3 mol/L ;其电离度也不是 1 . 33% ,而是 1 . 68% 了。这种影响,叫...
 [注解与辨疑j] 决定强、弱电解质的因素是什么? 作者:龙立球 来源:未知 日期:2018-07-19 16:27:16 点击:19513 所属专题:弱电解质
[注解与辨疑j] 决定强、弱电解质的因素是什么? 作者:龙立球 来源:未知 日期:2018-07-19 16:27:16 点击:19513 所属专题:弱电解质
决定强、弱电解质的因素较多,有时一种物质在某种情况下是强电解质,而在另一种情况下,又可以是弱电解质。下面从键型、键能、溶解度、浓度和溶剂等方面来讨论这些因素对电解质电离的影响。 (1)电解质的键型不同,电离程度就不同。 已知典型的离子化合物,如强碱(NaOH、...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【导读】与第一电离能定义相反(并非严格互逆过程),第一电子亲和能是指基态的气态原子...
【导读】 根据 质子酸碱 理论: 酸是 质子的给予体 , 给出质子 (H ) 的物质 ; 碱是 ...
电离概念是中学一个基本概念,用以区分电解质和非电解质、共价化合物和离子化合物。其...
1. 如何理解 “ 水解 ” 反应的概念? “ 水解 ” ,顾名思义,可理解为 “ 某物质遇...
为什么NaHCO 3 溶液能与Na[Al(OH) 4 ]溶液反应? NaHSO 3 溶液之所以能与Na[Al(OH) 4 ...
双水解程度计算: 同样是双水解,为什么CH 3 COO - 和 NH 4 + 可以大量共存,而Al 3...
我们在看到酸碱中和滴定图像时,看到反应一半点处图像很平缓,这是因为这一部分成分构...
请教:恒温下向CH 3 COONa稀溶液中加入少量固体醋酸钠 c (CH 3 COO - )/ c (Na + )...