
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑j] “质子守恒”原理 作者:翟娜 来源:未知 日期:2011-03-02 20:30:21 点击:38374 所属专题:质子守恒
[注解与辨疑j] “质子守恒”原理 作者:翟娜 来源:未知 日期:2011-03-02 20:30:21 点击:38374 所属专题:质子守恒
根据酸碱质子理论,酸碱反应的本质是质子的传递,当反应达到平衡时,酸失去的质子和碱得到的质子的物质的量必然相等。其数学表达式称为质子守恒式或质子条件式,常用符号PBE表示。 求质子条件式的方法有两种。一种是由物料守恒式和电荷守恒式推导(质子守恒=电荷守恒...
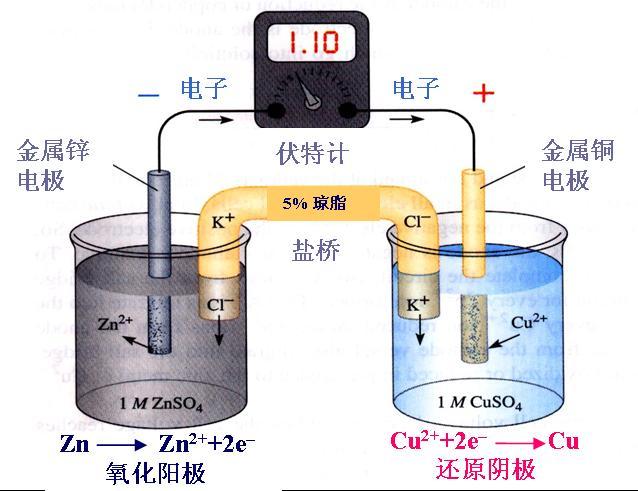 [注解与辨疑j] 难溶电解质的溶解平衡 作者:张澳 来源:未知 日期:2011-02-23 17:29:20 点击:2523 所属专题:溶解平衡
[注解与辨疑j] 难溶电解质的溶解平衡 作者:张澳 来源:未知 日期:2011-02-23 17:29:20 点击:2523 所属专题:溶解平衡
氢氧化钡溶液和硫酸溶液混合,刚好完全反应,产生硫酸钡白色沉淀。滤去沉淀后,留下的滤液是硫酸钡饱和溶液。另一个例子是把氯化银投入水中,请问水里有银离子和氯离子吗?答案是肯定的。虽然很少,但不能否认它们的存在。难溶不等于一点都不溶,当溶解速度等于沉淀速度,...
 [注解与辨疑j] 电解质溶液的是非判断 作者:章金莲 来源:未知 日期:2010-09-30 20:58:06 点击:7848 所属专题:电解质溶液 是非判断
[注解与辨疑j] 电解质溶液的是非判断 作者:章金莲 来源:未知 日期:2010-09-30 20:58:06 点击:7848 所属专题:电解质溶液 是非判断
1. 0.1摩尔/升氨水中[OH - ]是0.2摩尔氨水[OH - ]的1/2倍。 2.用水稀释氨水,其中电离度和c(OH - )同增大,导电性也增强。 3.PH=0的溶液,表示溶液不显酸性。 4.PH值相同的硫酸和盐酸溶液中[H + ]相同。 5 ....
 [注解与辨疑j] 双水解反应的分类、条件及其应用 作者:桂耀荣 来源:未知 日期:2020-03-15 12:51:25 点击:17386 所属专题:双水解反应
[注解与辨疑j] 双水解反应的分类、条件及其应用 作者:桂耀荣 来源:未知 日期:2020-03-15 12:51:25 点击:17386 所属专题:双水解反应
一、双水解的分类及判断依据: 1、双水解的分类: 根据水解程度的大小,通常将双水解分为两类。一类叫一般双水解,另一类叫完全双水解。 一般双水解:对于像醋酸铵、氟化铵这类的弱酸弱碱盐,它们的阴、阳离子都水解,导致水解相互促进,较一般的水解如醋酸钠的水解程度...
 [注解与辨疑j] 电解质溶液重要的知识归纳 作者:李从山 来源:未知 日期:2010-07-23 10:08:54 点击:23513 所属专题:电解质溶液
[注解与辨疑j] 电解质溶液重要的知识归纳 作者:李从山 来源:未知 日期:2010-07-23 10:08:54 点击:23513 所属专题:电解质溶液
1、能证明HA为弱电解质的事实有: (1)溶液中有电解质的分子、离子共存。 (2)相同条件下与同浓度的盐酸相比较导电能力弱。 (3)0.1mol/L HA溶液pH1 (4)0.1mol/L NaA溶液 pH7 (5)同pH的HCl、 HA稀释相同倍数,HA溶液的pH比HCl小. (6)同体积,同pH的HCl、HA与足量的...
 [注解与辨疑j] 弱酸的酸性强弱顺序 作者:秦文鑫 来源:未知 日期:2016-02-02 21:33:44 点击:15550 所属专题:酸性
[注解与辨疑j] 弱酸的酸性强弱顺序 作者:秦文鑫 来源:未知 日期:2016-02-02 21:33:44 点击:15550 所属专题:酸性
顺口溜:亚硫磷酸氢氟酸,亚硝酸 ,甲酸苯甲冰醋酸,碳酸氢硫次氯酸,氰氢后面是苯酚。即H 2 SO 3 H 3 PO 4 HFHNO 2 HCOOH苯甲酸CH 3 COOHH 2 CO 3 H 2 S次氯酸HCN 苯酚,其他常见酸如HClO 4 , H 2 SO 4 ,HNO 3 ,HI,HBr都是强酸,强酸在水里视作酸性等同。 碱性:Fe(OH...
 [注解与辨疑j] 碳酸氢钠溶液中微粒浓度关系 作者:毛远明 来源: 日期:2016-02-02 21:32:31 点击:13912 所属专题:碳酸氢钠01 离子浓度大小比较
[注解与辨疑j] 碳酸氢钠溶液中微粒浓度关系 作者:毛远明 来源: 日期:2016-02-02 21:32:31 点击:13912 所属专题:碳酸氢钠01 离子浓度大小比较
碳酸氢钠溶于水后,存在下列电离过程和水解过程: NaHCO 3 =Na + +HCO 3 - HCO 3 - H + +CO 3 2- H 2 O H + +OH - HCO 3 - +H 2 O H 2 CO 3 +OH - 在碳酸氢钠溶液中,存在两种分子和五种离子。 一、 大小关系...
 [注解与辨疑j] 几个关于电解质溶液的疑点解析 作者:王辉 来源: 日期:2007-12-22 02:10:07 点击:5570 所属专题:电解质
[注解与辨疑j] 几个关于电解质溶液的疑点解析 作者:王辉 来源: 日期:2007-12-22 02:10:07 点击:5570 所属专题:电解质
1. 强电解质溶液一定完全电离吗 中学阶段,一般认为强电解质在水分子作用下全部电离,而弱电解质则部分电离,这也是区别强弱电解质的依据。而实际上,强电解质并非全部(100%)电离。例如:18℃时,0.1mol/L盐酸的电离度(溶液中已电离的电解质分子数和电解质分子总数...
 [注解与辨疑j] pH试纸使用过程中所涉及的化学问题 作者:樊会武 来源: 日期:2012-05-15 18:48:17 点击:8711 所属专题:ph试纸
[注解与辨疑j] pH试纸使用过程中所涉及的化学问题 作者:樊会武 来源: 日期:2012-05-15 18:48:17 点击:8711 所属专题:ph试纸
pH 试纸是由多种有机弱酸和有机弱碱浸泡而成的,本身为姜黄色。通到酸碱度不同的溶液,可显示十四种颜色。可定性测定气态物质的酸碱性,也可定量测定溶液的酸碱度。现对其使用过程中涉及的一些问题加以总结。 一、定性测定气态物质的酸碱性 气态物质显酸性(或碱性)是...
 [注解与辨疑j] 常见的强电解质和弱电解质 作者:林夕 来源: 日期:2018-07-19 15:57:46 点击:32811 所属专题:弱电解质判断
[注解与辨疑j] 常见的强电解质和弱电解质 作者:林夕 来源: 日期:2018-07-19 15:57:46 点击:32811 所属专题:弱电解质判断
常见的强电解质: 强酸: HCl 、 HBr 、 HI 、 H 2 SO 4 、 HNO 3 、 HClO 3 、 HClO 4 等。 NaOH 、 KOH 、 Ba(OH) 2 、 Ca(OH) 2 等。 NaCl 、 (NH 4 ) 2 SO 4 、 Fe(NO 3 ) 3 、 BaSO 4 等。 HF 、 HClO 、 H 2 S 、 H 2 SO 3 、 H 3 PO 4 、 H 2 CO 3 、 弱碱: 少...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【导读】与第一电离能定义相反(并非严格互逆过程),第一电子亲和能是指基态的气态原子...
【导读】 根据 质子酸碱 理论: 酸是 质子的给予体 , 给出质子 (H ) 的物质 ; 碱是 ...
电离概念是中学一个基本概念,用以区分电解质和非电解质、共价化合物和离子化合物。其...
1. 如何理解 “ 水解 ” 反应的概念? “ 水解 ” ,顾名思义,可理解为 “ 某物质遇...
为什么NaHCO 3 溶液能与Na[Al(OH) 4 ]溶液反应? NaHSO 3 溶液之所以能与Na[Al(OH) 4 ...
双水解程度计算: 同样是双水解,为什么CH 3 COO - 和 NH 4 + 可以大量共存,而Al 3...
我们在看到酸碱中和滴定图像时,看到反应一半点处图像很平缓,这是因为这一部分成分构...
请教:恒温下向CH 3 COONa稀溶液中加入少量固体醋酸钠 c (CH 3 COO - )/ c (Na + )...