
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑j] 为什么氢氟酸电离后放热? 作者:化学自习室 来源:未知 日期:2023-09-14 15:32:27 点击:1959 所属专题:氢氟酸
[注解与辨疑j] 为什么氢氟酸电离后放热? 作者:化学自习室 来源:未知 日期:2023-09-14 15:32:27 点击:1959 所属专题:氢氟酸
氢氟酸在溶于水的时候,先解离成氢离子和氟离子,这个过程需要吸收热量。 氢离子和氟离子在水溶液中以水合离子形式存在,水合是放热过程,离子半径极大或极小时,水合热很大,氟离子半径很小,所以溶解时水和热很大,甚至超过了解离时吸收的能量。即氢氟酸电离整体过程...
 [注解与辨疑j] 碱度与pH之间关系 作者:化学自习室 来源:未知 日期:2023-03-06 08:16:24 点击:1537 所属专题:pH
[注解与辨疑j] 碱度与pH之间关系 作者:化学自习室 来源:未知 日期:2023-03-06 08:16:24 点击:1537 所属专题:pH
经常有小伙伴搞混碱度与pH的关系,碱度与pH并不是一个概念,实际意义也不同,碱度说明的是缓冲能力,pH是酸碱性的直接表现!一个是内功一个是招式的区别! 1、什么是pH? pH值,亦称氢离子浓度指数、酸碱值,是溶液中氢离子活度的一种标度,也就是通常意义上溶液酸碱程...
 [注解与辨疑j] 平衡常数有哪些?水要不要写进平衡常数表达式中? 作者:刘凯 来源:化学教学与研究 日期:2023-02-22 14:56:48 点击:627 所属专题:平衡常数
[注解与辨疑j] 平衡常数有哪些?水要不要写进平衡常数表达式中? 作者:刘凯 来源:化学教学与研究 日期:2023-02-22 14:56:48 点击:627 所属专题:平衡常数
...
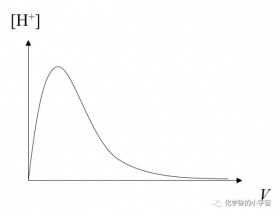 [注解与辨疑j] 用平衡常数解释冰醋酸稀释时氢离子浓度的变化 作者:化学自习室 来源:未知 日期:2023-01-10 10:33:36 点击:1731 所属专题:电离平衡常数
[注解与辨疑j] 用平衡常数解释冰醋酸稀释时氢离子浓度的变化 作者:化学自习室 来源:未知 日期:2023-01-10 10:33:36 点击:1731 所属专题:电离平衡常数
弱电解质电离中的一个常见问题是:冰醋酸逐滴加水稀释,溶液中氢离子浓度的变化情况为何?只需想到不加水时或加无穷多水时溶液中氢离子浓度都很小(前者因为无水难电离,后者因为太稀了),答案就很简单了:先增大后减...
 [注解与辨疑j] 指示剂选择的一般原则及计算分析 作者:化学自习室 来源:未知 日期:2022-08-03 15:46:11 点击:1664 所属专题:指示剂选择
[注解与辨疑j] 指示剂选择的一般原则及计算分析 作者:化学自习室 来源:未知 日期:2022-08-03 15:46:11 点击:1664 所属专题:指示剂选择
几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4、②甲基红4.4~6.2③酚酞8.2~10,现用0.1000mol·L -1 NaOH溶液滴定浓度相近的甲酸时,上述指示剂( ) A.都可以用 B.只能用③ C.可以用①或② D.可以用②或③ 此题的正确选项应为B。那么如何解答酸碱中和滴定时其指示剂的选...
 [注解与辨疑j] 紫色石蕊试液及蓝色和红色石蕊试纸 作者:化学自习室 来源:未知 日期:2022-07-31 09:19:15 点击:5247 所属专题:酸碱指示剂
[注解与辨疑j] 紫色石蕊试液及蓝色和红色石蕊试纸 作者:化学自习室 来源:未知 日期:2022-07-31 09:19:15 点击:5247 所属专题:酸碱指示剂
1.什么是石蕊试液? 石蕊试液本身为紫色,它遇酸变红色,遇碱变蓝色。如果显紫色,则是中性。用于帮助判断液体的酸碱性(但无法知道准确pH值)。 2.常见的石蕊试纸有两种: (1)红色石蕊试纸,它遇碱变蓝色。 红色石蕊试纸是事先用酸性物质处理过的石蕊试纸,用来检验...
 [注解与辨疑j] 酚酞的化学性质、结构及酚酞指示剂 作者:化学自习室 来源:未知 日期:2022-07-31 09:10:43 点击:7916 所属专题:酸碱指示剂
[注解与辨疑j] 酚酞的化学性质、结构及酚酞指示剂 作者:化学自习室 来源:未知 日期:2022-07-31 09:10:43 点击:7916 所属专题:酸碱指示剂
1.酚酞的化学性质? 酚酞是一种弱有机酸,常温下为白色或微带黄色的细小晶体,无臭,无味,难溶于水而易溶于酒精(乙醇)、乙醚。 溶解在酒精溶液中制成酸碱指示剂,在酸性溶液中呈无色,在碱液或碱金属的碳酸盐溶液中呈红色,但如果在浓碱溶液中则会生成无色的三金属盐...
 [注解与辨疑j] 难溶电解质的3个教学误区 作者:陈彬城 来源:化学教育期刊 日期:2022-07-21 10:06:45 点击:1296 所属专题:溶解平衡
[注解与辨疑j] 难溶电解质的3个教学误区 作者:陈彬城 来源:化学教育期刊 日期:2022-07-21 10:06:45 点击:1296 所属专题:溶解平衡
一、问题的提出 难溶电解质是近几年高考选择题的考查热点,主要考查溶度积 K sp 的大...
 [注解与辨疑j] 为什么水的离子积常数Kw只适用于稀溶液? 作者:化学自习室 来源:未知 日期:2022-03-10 16:38:59 点击:5107 所属专题:水的离子积常数
[注解与辨疑j] 为什么水的离子积常数Kw只适用于稀溶液? 作者:化学自习室 来源:未知 日期:2022-03-10 16:38:59 点击:5107 所属专题:水的离子积常数
【一般情况】 水是一种极弱的电解质,可以发生微弱的电离,其电离方程式为:H 2 O+H 2 O≒H 3 O + + OH - ,简写为H 2 O≒H + + OH - ,是一个吸热过程。 水的电离是水分子与水分子之间的相互作用而引起的,因此极难发生,大约55.5×10 8 个水分子中只有1个水分子发...
 [注解与辨疑j] 沉淀溶解平衡中的三大误区 作者:化学自习室 来源:未知 日期:2022-03-10 10:21:02 点击:1165 所属专题:溶解平衡
[注解与辨疑j] 沉淀溶解平衡中的三大误区 作者:化学自习室 来源:未知 日期:2022-03-10 10:21:02 点击:1165 所属专题:溶解平衡
误区一 难溶电解质的Ksp越大,其溶解度越大 误区二 Ksp大的沉淀能转化为Ksp小的沉淀,Ksp小的沉淀不能转化为Ksp大的沉淀 误区三 溶解度大的沉淀能转化为溶解度小的沉淀,溶解度小的沉淀不能转化为溶解度大的沉淀 小结...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
酚酞变红的核心原理,是它在碱性溶液中发生了分子结构的转变...
什么是“软硬酸碱理论”,1963 年,拉尔夫・皮尔逊提出软硬酸...
水溶液中NH水解显酸性,CO、HCO水解显碱性,二者会发生“相互促...
在基础化学中,我们常被告知:盐类水解通常是微弱且可逆的。...
一般来说,溶解度大的物质易转化为溶解度小的物质。那反过来...
一.定义 1.pH pH=–log[H] pH是衡量溶液整体酸碱度的指标,具体指溶...
溶解度(Solubility)与溶度积常数(Solubility Product Constant, ksp密切...
【导读】与第一电离能定义相反(并非严格互逆过程),第一电子...