
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑j] 平衡常数有哪些?水要不要写进平衡常数表达式中? 作者:刘凯 来源:化学教学与研究 日期:2023-02-22 14:56:48 点击:626 所属专题:平衡常数
[注解与辨疑j] 平衡常数有哪些?水要不要写进平衡常数表达式中? 作者:刘凯 来源:化学教学与研究 日期:2023-02-22 14:56:48 点击:626 所属专题:平衡常数
...
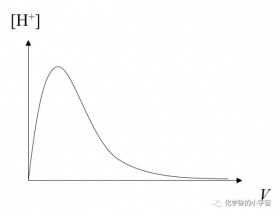 [注解与辨疑j] 用平衡常数解释冰醋酸稀释时氢离子浓度的变化 作者:化学自习室 来源:未知 日期:2023-01-10 10:33:36 点击:1726 所属专题:电离平衡常数
[注解与辨疑j] 用平衡常数解释冰醋酸稀释时氢离子浓度的变化 作者:化学自习室 来源:未知 日期:2023-01-10 10:33:36 点击:1726 所属专题:电离平衡常数
弱电解质电离中的一个常见问题是:冰醋酸逐滴加水稀释,溶液中氢离子浓度的变化情况为何?只需想到不加水时或加无穷多水时溶液中氢离子浓度都很小(前者因为无水难电离,后者因为太稀了),答案就很简单了:先增大后减...
 [注解与辨疑j] 指示剂选择的一般原则及计算分析 作者:化学自习室 来源:未知 日期:2022-08-03 15:46:11 点击:1655 所属专题:指示剂选择
[注解与辨疑j] 指示剂选择的一般原则及计算分析 作者:化学自习室 来源:未知 日期:2022-08-03 15:46:11 点击:1655 所属专题:指示剂选择
几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4、②甲基红4.4~6.2③酚酞8.2~10,现用0.1000mol·L -1 NaOH溶液滴定浓度相近的甲酸时,上述指示剂( ) A.都可以用 B.只能用③ C.可以用①或② D.可以用②或③ 此题的正确选项应为B。那么如何解答酸碱中和滴定时其指示剂的选...
 [注解与辨疑j] 紫色石蕊试液及蓝色和红色石蕊试纸 作者:化学自习室 来源:未知 日期:2022-07-31 09:19:15 点击:5236 所属专题:酸碱指示剂
[注解与辨疑j] 紫色石蕊试液及蓝色和红色石蕊试纸 作者:化学自习室 来源:未知 日期:2022-07-31 09:19:15 点击:5236 所属专题:酸碱指示剂
1.什么是石蕊试液? 石蕊试液本身为紫色,它遇酸变红色,遇碱变蓝色。如果显紫色,则是中性。用于帮助判断液体的酸碱性(但无法知道准确pH值)。 2.常见的石蕊试纸有两种: (1)红色石蕊试纸,它遇碱变蓝色。 红色石蕊试纸是事先用酸性物质处理过的石蕊试纸,用来检验...
 [注解与辨疑j] 酚酞的化学性质、结构及酚酞指示剂 作者:化学自习室 来源:未知 日期:2022-07-31 09:10:43 点击:7905 所属专题:酸碱指示剂
[注解与辨疑j] 酚酞的化学性质、结构及酚酞指示剂 作者:化学自习室 来源:未知 日期:2022-07-31 09:10:43 点击:7905 所属专题:酸碱指示剂
1.酚酞的化学性质? 酚酞是一种弱有机酸,常温下为白色或微带黄色的细小晶体,无臭,无味,难溶于水而易溶于酒精(乙醇)、乙醚。 溶解在酒精溶液中制成酸碱指示剂,在酸性溶液中呈无色,在碱液或碱金属的碳酸盐溶液中呈红色,但如果在浓碱溶液中则会生成无色的三金属盐...
 [注解与辨疑j] 难溶电解质的3个教学误区 作者:陈彬城 来源:化学教育期刊 日期:2022-07-21 10:06:45 点击:1288 所属专题:溶解平衡
[注解与辨疑j] 难溶电解质的3个教学误区 作者:陈彬城 来源:化学教育期刊 日期:2022-07-21 10:06:45 点击:1288 所属专题:溶解平衡
一、问题的提出 难溶电解质是近几年高考选择题的考查热点,主要考查溶度积 K sp 的大...
 [注解与辨疑j] 为什么水的离子积常数Kw只适用于稀溶液? 作者:化学自习室 来源:未知 日期:2022-03-10 16:38:59 点击:5102 所属专题:水的离子积常数
[注解与辨疑j] 为什么水的离子积常数Kw只适用于稀溶液? 作者:化学自习室 来源:未知 日期:2022-03-10 16:38:59 点击:5102 所属专题:水的离子积常数
【一般情况】 水是一种极弱的电解质,可以发生微弱的电离,其电离方程式为:H 2 O+H 2 O≒H 3 O + + OH - ,简写为H 2 O≒H + + OH - ,是一个吸热过程。 水的电离是水分子与水分子之间的相互作用而引起的,因此极难发生,大约55.5×10 8 个水分子中只有1个水分子发...
 [注解与辨疑j] 沉淀溶解平衡中的三大误区 作者:化学自习室 来源:未知 日期:2022-03-10 10:21:02 点击:1163 所属专题:溶解平衡
[注解与辨疑j] 沉淀溶解平衡中的三大误区 作者:化学自习室 来源:未知 日期:2022-03-10 10:21:02 点击:1163 所属专题:溶解平衡
误区一 难溶电解质的Ksp越大,其溶解度越大 误区二 Ksp大的沉淀能转化为Ksp小的沉淀,Ksp小的沉淀不能转化为Ksp大的沉淀 误区三 溶解度大的沉淀能转化为溶解度小的沉淀,溶解度小的沉淀不能转化为溶解度大的沉淀 小结...
 [注解与辨疑j] 关于沉淀溶解平衡的问题 作者:王笃年 来源:未知 日期:2021-11-01 16:16:17 点击:1728 所属专题:溶解平衡
[注解与辨疑j] 关于沉淀溶解平衡的问题 作者:王笃年 来源:未知 日期:2021-11-01 16:16:17 点击:1728 所属专题:溶解平衡
问题1、Ksp与 溶 解 度 (S)哪 一 个 更 科 学、更 准确?为什么先学习了S 后又要学习Ksp? 对于任何“固体—液体”混合体系而言,结晶(沉淀)—溶解平衡是客观存在的规律,当溶液中溶质粒子的浓度较小时,主要发生溶解过程,当溶液中粒子浓度过大时,则主要...
 [注解与辨疑j] 中和滴定原理与操作的问题讨论 作者:王笃年 来源:未知 日期:2021-10-29 15:40:28 点击:808 所属专题:中和滴定
[注解与辨疑j] 中和滴定原理与操作的问题讨论 作者:王笃年 来源:未知 日期:2021-10-29 15:40:28 点击:808 所属专题:中和滴定
问题1、“完全中和”的含义是什么?酸与碱完全中和时,溶液的pH=7吗? “完全中和”是一个概念,指酸与碱恰好反应生成盐,与此时溶液是否恰好呈中性(pH=7)无关。如果HCl与NaOH完全反应,生成NaCl,pH=7;如果HCl与NH 3 ·H 2 O完全反应,生成NH 4 Cl,pH<7;如果CH 3 COO...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
什么是“软硬酸碱理论”,1963 年,拉尔夫・皮尔逊提出软硬酸...
水溶液中NH水解显酸性,CO、HCO水解显碱性,二者会发生“相互促...
在基础化学中,我们常被告知:盐类水解通常是微弱且可逆的。...
一般来说,溶解度大的物质易转化为溶解度小的物质。那反过来...
一.定义 1.pH pH=–log[H] pH是衡量溶液整体酸碱度的指标,具体指溶...
溶解度(Solubility)与溶度积常数(Solubility Product Constant, ksp密切...
【导读】与第一电离能定义相反(并非严格互逆过程),第一电子...
【导读】 根据 质子酸碱 理论: 酸是 质子的给予体 , 给出质子...