
|
学习小专题 |

|
学习小专题 |
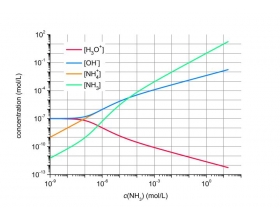 [注解与辨疑j] 氨气溶于水会不会促进水的电离?还是抑制? 作者:化学自习室 来源:未知 日期:2019-08-24 09:12:41 点击:3594 所属专题:水的电离
[注解与辨疑j] 氨气溶于水会不会促进水的电离?还是抑制? 作者:化学自习室 来源:未知 日期:2019-08-24 09:12:41 点击:3594 所属专题:水的电离
氨气溶于水抑制水的电离。 该体系内有两个化学平衡: 氨气与水反应,生成氢氧根离子并消耗水。直观来看,体系pH上升表明氢氧根离子的浓度有了数量级的改变;而由于是水溶液体系,水的消耗是可以忽略不计的。因此,水的电离平衡中产物增加,反应物基本不变,根据勒夏特列...
 [注解与辨疑j] 溶解度较小的难溶电解质能否转化为溶解度较大的难溶电解质? 作者:蔡惠君 来源:未知 日期:2020-03-09 13:58:21 点击:2192 所属专题:沉淀转化 溶度积计算
[注解与辨疑j] 溶解度较小的难溶电解质能否转化为溶解度较大的难溶电解质? 作者:蔡惠君 来源:未知 日期:2020-03-09 13:58:21 点击:2192 所属专题:沉淀转化 溶度积计算
以BaSO 4 沉淀转化为BaCO 3 沉淀为例。 K sp (BaSO 4 )=1.07×10 -10 , K sp (BaCO 3 )=2.58×10 -9 。 溶度积: K sp (BaSO 4 ) < K sp (BaCO 3 ),但相差不大,工业上能实现BaSO 4 沉淀转化为BaCO 3 沉淀,具体做法是把BaSO 4 置于一定量的饱和Na 2 CO 3 溶液中浸...
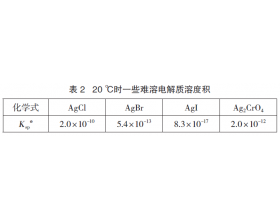 [注解与辨疑j] 混合液与同一种沉淀剂反应,一定是溶度积小的先沉淀吗? 作者:蔡惠君 来源:未知 日期:2019-06-28 10:22:44 点击:2332 所属专题:沉淀转化
[注解与辨疑j] 混合液与同一种沉淀剂反应,一定是溶度积小的先沉淀吗? 作者:蔡惠君 来源:未知 日期:2019-06-28 10:22:44 点击:2332 所属专题:沉淀转化
例5 已知下列物质在20 ℃下的 K sp .,见表2。 向含有浓度均为0.01 mol·L -1 的Cl - 、Br - 、I - 和Cr O 4 2 - 的溶液中,滴加AgNO 3 溶液,生成沉淀的先后顺序如何判断? 解析:AgCl、AgBr、AgI 均是AB型,它们的溶解度可由 K sp 直接判断, K sp : K sp (AgCl) >...
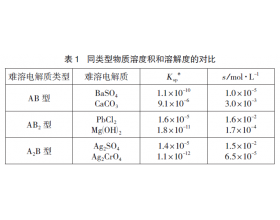 [注解与辨疑j] 难溶电解质溶度积越小,溶解度一定越小吗? 作者:蔡惠君 来源:未知 日期:2019-06-28 10:02:16 点击:5851 所属专题:溶度积与溶解度
[注解与辨疑j] 难溶电解质溶度积越小,溶解度一定越小吗? 作者:蔡惠君 来源:未知 日期:2019-06-28 10:02:16 点击:5851 所属专题:溶度积与溶解度
从表1 可知: ①相同类型的难溶电解质(如同是AB 型或AB 2 型), 溶度积 K sp :CaCO 3 > BaSO 4 ,溶解度S:CaCO 3 > BaSO 4 ; 溶度积 K sp :Mg(OH) 2 < PbCl 2 ,溶解度S:Mg(OH) 2 < PbCl 2 。 在相同温度下,对于相同类型的难溶电解质,可用溶度积直接比较其溶解度...
 [注解与辨疑j] 盐类水解疑难问集 作者:张高豪 来源:未知 日期:2019-06-28 07:34:47 点击:964 所属专题:盐类水解
[注解与辨疑j] 盐类水解疑难问集 作者:张高豪 来源:未知 日期:2019-06-28 07:34:47 点击:964 所属专题:盐类水解
盐类的水解是高中化学的一个重点内容,与电离、物质的浓度、、强弱电解质等概念联系在一起,解决问题时思维容量大,要想学好这一部分内容,需分析清楚其中的道理,下面举几例: 1.CH 3 COONa电离出CH 3 COO - 会水解,CH 3 COOH溶液中的CH 3 COO - 是否会水解 解析:...
 [注解与辨疑j] 论由Ksp较小的沉淀能否转化为Ksp较大的沉淀 作者:钱明安 来源:未知 日期:2020-03-09 15:26:39 点击:3069 所属专题:沉淀转化
[注解与辨疑j] 论由Ksp较小的沉淀能否转化为Ksp较大的沉淀 作者:钱明安 来源:未知 日期:2020-03-09 15:26:39 点击:3069 所属专题:沉淀转化
...
 [注解与辨疑j] 有关沉淀转化与Ksp大小的讨论 作者:徐明奎 来源:未知 日期:2020-03-09 15:35:20 点击:3370 所属专题:沉淀转化
[注解与辨疑j] 有关沉淀转化与Ksp大小的讨论 作者:徐明奎 来源:未知 日期:2020-03-09 15:35:20 点击:3370 所属专题:沉淀转化
第一页 第二页 第三页...
 [注解与辨疑j] 利用平衡常数解释难溶物的溶解问题 作者:化学自习室 来源:未知 日期:2019-06-11 16:12:48 点击:1793 所属专题:化学平衡常数 沉淀转化
[注解与辨疑j] 利用平衡常数解释难溶物的溶解问题 作者:化学自习室 来源:未知 日期:2019-06-11 16:12:48 点击:1793 所属专题:化学平衡常数 沉淀转化
高中化学新课程在选修4中引入了平衡常数的概念, 在中学化学中, 师生常常遇到一些难以深入解释的溶解问题。如氨水和MgCl 2 溶液反应生成Mg(OH) 2 沉淀, 而该沉淀又能溶于NH 4 Cl,氨水和FeCl 3 溶液反应生成Fe(OH) 3 沉淀, 但Fe(OH) 3 却不能溶于NH 4 Cl溶液.FeS能溶于强...
 [注解与辨疑j] 二氧化碳通入溶液中,少量与过量是否一样? 作者:骆传汉 来源:未知 日期:2019-05-30 20:58:34 点击:4275 所属专题:二氧化碳 强酸制弱酸
[注解与辨疑j] 二氧化碳通入溶液中,少量与过量是否一样? 作者:骆传汉 来源:未知 日期:2019-05-30 20:58:34 点击:4275 所属专题:二氧化碳 强酸制弱酸
一、少量、过量不一样 1、二氧化碳通入偏铝酸钠溶液 H 2 CO 3 >Al(OH) 3 >HC O 3 - 现象:都是产生白色沉淀 少量:2 NaAlO 2 +CO 2 +3 H 2 O = 2Al(OH) 3 ↓ + Na 2 CO 3 过量:NaAlO 2 +CO 2 +2 H 2 O = Al(OH) 3 ↓+ NaHCO 3 2、二氧化碳通入次氯酸钙溶液中 少量...
 [注解与辨疑j] 定量分析硫化钙为什么遇水分解? 作者:刘琦英 来源:未知 日期:2019-05-17 08:26:32 点击:969 所属专题:双水解反应
[注解与辨疑j] 定量分析硫化钙为什么遇水分解? 作者:刘琦英 来源:未知 日期:2019-05-17 08:26:32 点击:969 所属专题:双水解反应
...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。1、 碳酸氢钠溶液pH计算公式的推导 注意: 值得注意的是,最后推导的公式从表面上看c(...
溶解度和溶度积换算 溶解度和溶度积均可以定量表示难溶物质的溶解性。 溶解度与溶度积...
...
酸碱滴定法 强酸滴定强碱的反应 强酸滴定弱碱的反应 混合碱的滴定(双指示剂法+滴定突...
【学生疑问】 教材上有两个实验,一个是 AgI 转化为 Ag 2 S,一个是 Mg(OH) 2 转化为 ...
25 ℃ 时, K a1 (H 2 S)=1.1 × 10 -7 ; K a2 (H 2 S)=1.3 × 10 -13 . (高等教育...
沉淀转化是沉淀溶解平衡的应用之一。 对于溶度积较大的沉淀转为溶度积较小的沉淀这类...
1.实例 常温下,用0.100 0 mol·L -1 NaOH溶液滴定20.00 mL 0.100 0 mol·L -1 CH 3...