
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
学生对强酸制取弱酸规律并不陌生,可当给定反应物酸“过量”或“少量”时,学生往往对于生成的盐是“正盐”还是“酸式盐”搞不清楚.
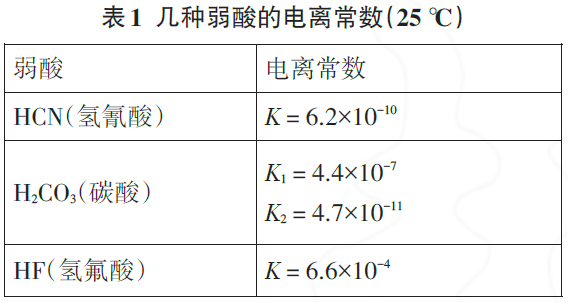
例2 (1)向Na2CO3溶液中加入少量HF溶液,反应离子方程式为 (数据参照表1 ,下同);若加入过量HF溶液,反应离子方程式为 ;
(2)向NaCN 溶液中通入少量的CO2,反应离子方程式为 .
分析:依据“强酸+弱酸盐=弱酸+强酸盐”原理,将该原理转变成“交叉”形式如下:

称之为“交叉”规律(实线连接的为反应物,虚线连接的为生成物),这样一来,反应的生成物一目了然.。它直观体现了反应原理中的“以强制弱”原理,该“交叉”规律也适用于氧化还原反应。
由表1数据,得出下面的结论及形式:
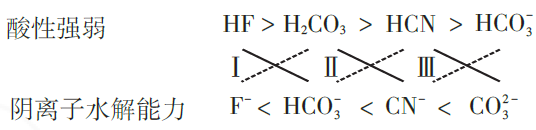
依据“交叉”规律易知反应有:
(Ⅰ)HF+HCO3-=F-+CO2 ↑+H2O;
(Ⅱ)CO2+H2O+ CN-= HCO3-+HCN(不论CO2多与少,都只生成HCO3-);
(Ⅲ)HCN+ CO32- = HCO3-+CN-(不论HCN多与少,都只生成HCO3-).
亦有结论:(Ⅳ)HF+CN-=F-+HCN;(Ⅴ)HF(少量)+ CO32- = HCO3-+F-.
若加入过量的HF 溶液,则为2HF(过量)+ CO32- =2F-+CO2↑+H2O.这是因为反应(Ⅴ)生成的NaHCO3再与多余HF发生反应(Ⅰ)HF+ HCO3-=F-+CO2↑+H2O,合并得2HF(过量)+ CO32- =2F-+CO2↑+H2O.

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生成 CuS 黑色沉淀和 ...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明怎样计算由水电离产生...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常数的计算、弱酸的相对强弱...
...
一、原理:影响水的电离平衡因素 H 2 O H + +OH - 1.25 ℃, → c (H + ) H2O = ...