
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.配位数可以等同于中心离子(或原子)与配位原子形成的配位键键数,也可以等同于配位体的数目。
如[Ag(NH3)2]nO3、[Ag(CN)2]-、[Cu(NH3)4]SO4、[Cu(H2O)4]2+、[Zn(NH3)4]2+、[Zn(CN)4]2-、K3[Fe(SCN)6]、[Fe(CN)6]3-、[FeF6]3-等配合物或配离子中的中心离子与配位体的数目以及配位原子形成的配位键键数均相等,其中Ag+离子的配位数为2,Cu2+离子与Zn2+离子的配位数均为4,Fe3+离子的配位数为6。
一般规律:一般配合物的配位数可以按中心离子电荷数的二倍来计算。
又如Ni(CO)4、Fe(CO)5、Cr(CO)6等羰基化合物中Ni、Fe、Cr原子的配位数分别为4、5、6。[Co(NH3)4(H2O)2]Cl2、[CrCl(H2O)5]Cl2中Co2+离子与Cr3+离子的配位数均为6。
说明:羰基化合物中的中心原子呈电中性,此类配合物的配位数由化学式直接判断。Co2+离子与Cr3+离子的电荷数分别为2、3,但配位数都是6。所以,配合物的配位数不一定按中心离子(或原子)的电荷数判断。
2.当中心离子(或原子)与多基配体配合时,配位数可以等同于配位原子的数目,但不是配位体的数目。
如[Cu(EN)2]中的EN是乙二胺(NH2CH2CH2NH2)的简写,属于双基配体,每个乙二胺分子有2个N原子与Cu2+离子配位,故Cu2+离子的配位数是4而不是2。
3.当中心离子(或原子)同时以共价键与配位键结合时,配位数不等于配位键的键数。
如[BF4]-、[B(OH)4]-、[AlCl4]-、[Al(OH)4]-等配离子中,B、Al原子均缺电子,它们形成的化学键,既有共价键,又有配位键,配位数与配位键的键数不相等,配位数均为4。
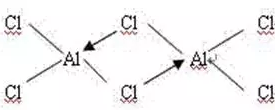
又如Al2Cl6(如下左图所示)中Al原子的配位数为4。
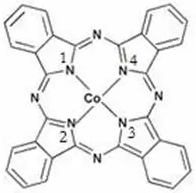
再如酞菁钴的结构(如下右图所示),钴离子的配位数为4。
4.当中心离子(或原子)与不同量的配位体配合时,其配位数为不确定。
如硫氰合铁络离子随着配离子SCN-浓度的增大,中心离子Fe3+与SCN-可以形成配位数为1~6的配合物:[Fe(SCN-)n]3-n(n=1~6)。
注意:中心离子的配位数多少与中心离子和配体的性质(如电荷数、体积大小、电子层结构等)以及它们之间相互影响、配合物的形成条件(如浓度、温度等)有关。配合物的配位数由1到14,其中最常见的配位数为4和6。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。分析: 依据价层电子对数计算公式分析, 可得价层电子对数=5=[2+3],故有2个配位原子...
...
比较键角大小分析思路: 参照以下顺序来判断键角大小 ①先从中心原子的杂化类型来入手...
顺反异构中,分子的对称性、极性以及熔点和沸点存在以下差异: 1.对称性比较 反式异构...
01 — 概念 在多原子分子(就是三个或三个以上的原子构成的分子)中,如有相互平行的p...
含有共价键的物质中相邻两键之间的夹角称为键角。键角是决定物质分子空间构型的主要因...