
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
配位化合物一般指由过渡金属的原子或离子(价电子层的部分d轨道和s、p轨道是空轨道)与含有孤对电子的分子(如CO、NH3、H2O)或离子(如Cl-、CN-、NO2-等)通过配位键结合形成的化合物。例如:[CO(NH3)6]Cl3、Fe(CO)5[Fe(C2O4)3]K3和[Cr(H2O)6]Cl3。
有些有机物也可以作为配体,比如(如烯烃、炔烃、烷基、芳香环、EN 即1,2-乙二胺 分子式:C2H8N2等等)、形成的配合物有[Co(EDTA)3]、(C5H5)Fe(CO)2CH3、K[Pt(C2H4)Cl3]、K[Pt(C2H4)Cl3],许许多多。
2019高考全国一卷35选做题:乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是(sp3)、(sp3)。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是(乙二胺的两个N提供孤对电子给金属离子形成配位键),其中与乙二胺形成的化合物稳定性相对较高的是(Cu2+)(填“Mg2+”或“Cu2+”)。
一、配位化合物按配位体分类,大体有:
①水合配合物。为金属离子与水分子形成的配合物,几乎所有金属离子在水溶液中都可形成水合配合物,如[Cu(H2O)4]2+、[Cr(H2O)6]3+。
②卤合配合物。金属离子与卤素(氟、氯、溴、碘)离子形成的配合物,绝大多数金属都可生成卤合配合物,如K2[PtCl4]、Na3[AlF6]。
③氨合配合物。金属离子与氨分子形成的配合物,如[Cu(NH3)4]SO4。
④氰合配合物。金属离子与氰离子形成的配合物 ,如K4[Fe(CN)6]。
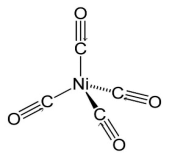
⑤金属羰基化合物。金属与羰基(CO)形成的配合物。如[Ni(CO)4]。
二、配位化合物按中心原子分类,可有:
①单核配合物。只有一个中心原子,如K2[COCl4][Cu(NH3)4]SO4,K4[Fe(CN)6]、[Pt(NH3)2Cl2]和[Ni(CO)4]都是单核配合物。
②多核配合物。中心原子数大于1,如[(H3N4CO(OH)(NH2)CO(H2NCH2CH2NH2)2]Cl4。
多核配合物有两个或两个以上配位原子:乙二胺H2NCH2CH2NH2是双齿配体,配位原子是两个n(原子);乙二胺四乙酸根(简称EDTA4-)(-OOCCH2)2N-CH2-CH2-N(CH2COO-)2是六齿配体,配位原子是两个N和四个羧基上的O。
配合物可为单核或多核,单核只有一个中心原子;多核有两个或两个以上中心原子。上述配合物均为单核配合物;多核配合物如[(CO)3Fe(CO)3Fe(CO)3]。
三、配位化合物按成键类型分类,可有:
①经典配合物。金属与有机基团之间形成 σ配位键,如[Al2(CH3)6]。
②簇状配合物。至少含有两个金属作为中心原子 ,其中还含有金属-金属键,如[W6(Cl12)Cl6]。
③含不饱和配位体的配合物。金属与配位体之间形成π-σ键或π-π×反馈键 ,如K[PtCl2(C2H4)]。
④夹心配合物。中心原子为金属,配位体为有机基团,金属原子被夹在两个平行的碳环体系之间,例如二茂铁[Fe(C5H5)2]。
⑤穴状配合物。配位体属于巨环多齿的有机化合物,如具有双环结构的N(CH2CH2OCH2CH2OCH2CH2)3N,它们与碱金属和碱土金属形成穴状配合物。
配合物一般来说是考百虑σ配键,由孤对电子或者多个不定域电子配位到中心原子空轨道上的σ配键;但如果在某些特殊的情况下,也是要考虑π键的,如一些 π 酸型配合物或者π型配合物,配合物中除了σ配键以外,还有反馈的π配键,由于这一类配合物的特殊的稳定性,所以在讨论它们的结构时,一定会涉及其π配键的问题。这是大学教材涉及到的内容,同学们以后会学到。
四、配合物中σ键和π键的判断
配位键有的是配位键既可以是σ键,也可以是π键,要根据具体情况来定。基本上高中的配位键都是σ键
1、Ni(CO)4中的羰基(CO)内C和O之间是共价三键,共价三键由一个σ键,两个π键组成,所以四个羰基共有4个σ键。
2、羰基与镍之间形成配位键,是σ键,这是由C的sp杂化轨道和Ni的sp3杂化轨道“头碰头”形成的。四个羰基一共与镍形成了4个σ键。所以Ni(CO)4中总共有8个σ键。
σ键是共价键的一专种。它具有如下特点:
1. σ键有方向性,两个成键原子必须沿着对称轴方向接近,才能达到最大重叠。
2. 成键电子云沿键轴对称分布,两端的原子可以沿轴自由旋转而不改变电子云密度的分布。
3. σ键是头碰头的重叠,与其它属键相比,重叠程度大,键能大,因此,化学性质稳定。
盐酸四氨合锌中有σ键的数目:
Zn(NH3)4Cl2 3×4+4=16
[Fe(CO)5] (其中含有10个π键,10个σ键)
[Fe(CN)6]3- 6+6=12

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。比较键角大小分析思路: 参照以下顺序来判断键角大小 ①先从中心原子的杂化类型来入手...
顺反异构中,分子的对称性、极性以及熔点和沸点存在以下差异: 1.对称性比较 反式异构...
01 — 概念 在多原子分子(就是三个或三个以上的原子构成的分子)中,如有相互平行的p...
含有共价键的物质中相邻两键之间的夹角称为键角。键角是决定物质分子空间构型的主要因...
1.非环状小分子和离子中的大π键:大多数满足AB n 型,可以计算杂化类型。 首先:参与...
1.σ键与π键 σ键:原子轨道沿着轨道对称轴的方向“头碰头”重叠形成的共价键。 π键...