
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
硫酸的吸水性是指其能将其它物质中的水吸收过来的性质,常用作气体的干燥剂,其实还可以利用浓硫酸的吸水性制取气体、使结晶水合物失去结晶水、从溶液析出晶体等,下面举例说明。
1.用于制取气体
实验室中可以利用浓硫酸的吸水性,让它与浓盐酸混合夺取溶液中的溶剂,使溶质HCl因过量及浓硫酸吸水过程中放出的热量导致溶解度减小而挥发出来。
例1:实验室欲用下列药品制取干燥的氯化氢气体:浓盐酸、稀盐酸、浓硫酸、稀硫酸、氢氧化钠固体、氢氧化钠溶液、氯化钙溶液。有关装置如右图。回答下列问题。
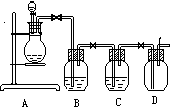
(1)制取干燥的氯化氢气体所需蒸药品为_____________。制备该气体的原理是_________________。
(2)为能产生平稳的气流,烧瓶中应盛放的药品是______,分液漏斗中应盛放的药品是_____。
(3)B中应盛放的药品是______,作用是_______,C中应盛放的药品是________。
(4)已知:H2C2O4→CO↑+CO2↑+H2O,故利用上述装置能否制取干燥纯净的CO_______,若能制取,则浓硫酸的作用是_____________,B、C中应分别盛放的试剂是_____________。
解析:实验室制备氯化氢气体的经典方法是用食盐与浓硫酸反应。但题中没有提供食盐。因升高温度或减少溶剂能使浓溶液中的气体溶质挥发出来,如向浓盐酸中加入浓硫酸,因浓硫酸具有吸水性而使溶液中溶剂减少,又因混合过程中会放出大量的热使溶液温度升高,从而导致溶质HCl在水中溶解量减小而挥发出来。故可用浓硫酸、浓盐酸来制取氯化氢气体。实验中应将浓硫酸通过分液漏斗慢慢加入盛放在烧瓶的盐酸中。因为这样操作,开始时盐酸浓度较大而硫酸(混合后)浓度较小、温度较低,而后来硫酸浓度较大、温度较高而盐酸浓度较小,故产生气体的速度相差较小。B、C中盛放的均是干燥剂,而能够用于干燥HCl气体的只有浓硫酸,故B、C中应盛放浓硫酸,用于除去气体中的水蒸气。该装置可用于制取CO气体,在制备中浓硫酸起脱水作用,因CO中混有酸性气体,故应先用NaOH溶液将其除掉。所以B中应盛放NaOH溶液,C中应盛放浓硫酸。![]()
2. 夺取结晶水
结晶水合物中的水虽然不是“自由”态的水,但浓硫酸仍能将其中的结晶水吸收过来(表现出吸水性),导致结晶水合物失去结晶水。
例2:将五水硫酸铜晶体放入浓硫酸中,固体颜色将变为
A蓝色 B黑色 C 白色 D 棕色
解析:浓硫酸具有吸水性而五水硫酸铜晶体含有结晶水,故该结晶水能被浓硫酸吸收过去,固体变成白色的无水硫酸铜,答案为C。
3.使溶液析出晶体
浓硫酸不仅能从气体混合物中、从结晶水合物中夺取水,而且还能从溶液中夺取水。
例3:如图所示,小试管内盛有约3mL 饱和硫酸铜溶液,与锥形瓶连通的U形管内盛有少量的水(为便于观察己染成红色)。沿小试管的内壁小心地慢慢注入约3mL 浓硫酸,静默片刻,不可能观察到的现象有
![]()
A小试管内的液体分为两层,上层蓝色,下层无色
B 有少量白色固体析出
C U形试管左边液面下降,右边液面上升
D 有少量蓝色晶体析出
解析:由于浓硫酸具有吸水性,加入到饱和硫酸铜溶液中后,会吸收溶液中的一部分溶剂而导致硫酸铜结晶析出,同时由于析出过程中存在浓硫酸(因密度较大沉在仪器底部),因此只能析出无水硫酸铜;又因为浓硫酸的密度大于硫酸铜溶液的密度,在题设的操作方式下,浓硫酸沉到试管的底部为无色,上层为蓝色的硫酸铜溶液;浓硫酸遇水会放出热量,导致试管中温度升高,压强增大而使U形管中左边液面下降,右边液面上升,故答案为D。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。二氧化硫与硫化钠溶液反应时,根据反应条件特别是二氧化硫的量的不同,可能产生不同的...
1、问题来源 2023年浙江6月选考T9 D.向硫化钠溶液通入足量二氧化硫: 因为硫离子和二...
...
浓硫酸与稀硫酸的分界线 我们所说的具有典型吸水性、脱水性和强氧化性的浓硫酸,指的...
稀硝酸比 浓硝酸 更稳定,不能够简单的理解浓度因素,实际上硝酸浓度越高,越不稳定,...
HSCN有硫氰酸(H - S - C ≡ N)和异硫氰酸(H - N = C = S)两种结构;但硫氰酸结构...