
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、分类:按照分子的极性,可把分子分为两类。
1. 非极性分子:正负电荷重心重合,分子对外不显示电负性的分子。例如:![]()
![]() 等。
等。
2. 极性分子:正负电荷重心不重合,分子对外显示电负性的分子。例如![]() HCl、H2O2等。
HCl、H2O2等。
二、掌握常见分子极性及其空间构型:常见分子极性及其空间构型可用下表表示。
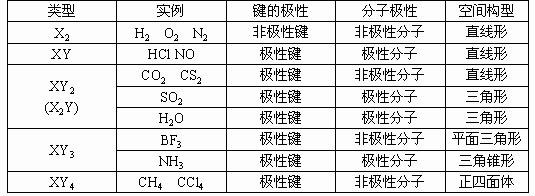
三、了解常见分子空间构型及其键角:中学常见分子空间构型及其键角列举如下:
(1)![]() 等双原子单质分子为直线形,夹角为180°。
等双原子单质分子为直线形,夹角为180°。
(2)![]() 为平面形,夹角为104.5°。
为平面形,夹角为104.5°。
(3)![]() 为三角锥形,夹角为107°18”。
为三角锥形,夹角为107°18”。
(4)![]() S为平面形,夹角为92°。
S为平面形,夹角为92°。
(5)![]() 为正四面体形,夹角为109°28”。
为正四面体形,夹角为109°28”。
(6)![]() 为四面体形,夹角不确定。
为四面体形,夹角不确定。
(7)![]() 为直线形,夹角为180°。
为直线形,夹角为180°。
(8)![]() 为平面形,夹角为120°。
为平面形,夹角为120°。
(9)![]() 为平面形,夹角为60°。
为平面形,夹角为60°。
(10)![]() 为正四面体形,夹角为109°28”。
为正四面体形,夹角为109°28”。
(11)![]() 为直线形,夹角为180°。
为直线形,夹角为180°。
(12)![]() 为平面形,夹角为120°。
为平面形,夹角为120°。
注意:中学常见的四面体物质有①CH4②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧![]() ⑨
⑨![]() 等。其中是正四面体的有①、⑤、⑥、⑦、⑧、⑨共6种。
等。其中是正四面体的有①、⑤、⑥、⑦、⑧、⑨共6种。
四、分子极性判断规律。
①双原子单质分子都是非极性分子。如![]() 等。
等。
②双原子化合物分子都是极性分子。如HCl、HBr、HI等。
③多原子分子极性要看空间构型是否对称,对称的是非极性分子,否则是极性分子。如H2O、![]() 等是极性分子;
等是极性分子;![]() 等是非极性分子。
等是非极性分子。
④![]() 形分子极性判断:若A原子的最外层电子全部参与成键,这种分子一般为非极性分子。如
形分子极性判断:若A原子的最外层电子全部参与成键,这种分子一般为非极性分子。如![]() 等。若A原子的最外层电子没有全部参与成键,这种分子一般为极性分子。如
等。若A原子的最外层电子没有全部参与成键,这种分子一般为极性分子。如![]() 等。
等。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。分析: 依据价层电子对数计算公式分析, 可得价层电子对数=5=[2+3],故有2个配位原子...
...
比较键角大小分析思路: 参照以下顺序来判断键角大小 ①先从中心原子的杂化类型来入手...
顺反异构中,分子的对称性、极性以及熔点和沸点存在以下差异: 1.对称性比较 反式异构...
01 — 概念 在多原子分子(就是三个或三个以上的原子构成的分子)中,如有相互平行的p...
含有共价键的物质中相邻两键之间的夹角称为键角。键角是决定物质分子空间构型的主要因...