
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、氯化铝是离子化合物还是共价化合物?
成键原子吸引电子能力的强弱可用电负性来度量,一般来说,非金属的电负性大于金属的电负性。成键原子的元素电负性相差越大,原子间形成键的极性就越强。一般来说,当电负性差值大于1.7时,形成的化学键为离子键;当电负性差值小于1.7时,形成的化学键为共价键。铝元素的电负性为1.5,氯元素的电负性为3.0,其差值小于1.7,所以氯化铝为共价化合物。且根据氯化铝的物理性质,易升华(沸点:181℃)、易熔化(熔点:194℃),可溶于四氯化碳等非极性溶剂,进一步确认氯化铝是共价分子。
2、氯化铝的分子结构
蒸汽密度表明,气态氯化铝的结构是以双聚分子Al2Cl6的形式存在的。因为铝原子是缺电子原子,氯原子是多电子原子,所以铝原子提供空轨道,氯原子提供孤对电子,形成Cl→Al配位键,每个铝原子周围均为近似四面体配位的氯原子,含有两个三中心四电子氯桥键。成键方式和空间构型如下图所示。
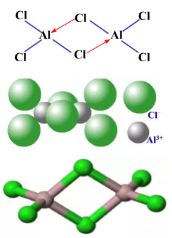
到800℃时,Al2Cl6完全分解为单分子AlCl3,其与BF3结构类似,为平面正三角形。
综上所述,无论是用中心原子化合价法还是用受力分析法解释,都表明氯化铝是非极性分子。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。通常而言,同主族元素形成的X-X键,自上而下,键长逐渐增大,键能逐渐降低。 根据元素...
无机化学实验是一门与无机化学理论课密切配合的课程。实验用化学事实充实了理论课的学...
能否形成氢键的“视点”:一看有无电负性...
1mol 氨中氢键数量分析 一、氢键形成机制 NH分子结构 H原子作为氢键供体(需与高电负性...
二氧化氮(NO)中氮原子的杂化类型为 sp杂化,具体分析如下: 1.计算 n (的价层电子对数...
...