
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氢键的内容课本上讲得不多,很容易被学生忽略,也是考试中的丢分点,我把有关内容归纳如下:
㈠定义
分子之间存在着一种比分子间作用力稍强的相互作用,这种静电吸引作用就是氢键。
㈡本质
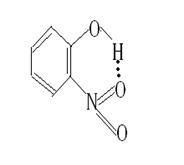
强极性键(X—H)上的氢核与电负性很大的孤对电子并带有部分负电荷的原子y之间的静电引力。它比化学键弱得多,只能在21千焦每摩尔左右,而一般化学键至少每摩尔有100多千焦。但比分子间作用力稍强,通常把氢键看作是一种比较强的分子间作用力。氢键结合的情况如果写成通式,可用X—H…Y表示,X与Y可以相同也可以不同,X与Y代表F、O、N等电负性大而原子半径较小的非金属原子,即相同分子或不同分子之间可能形成氢键。HF、H2O、NH3的分子之间存在氢键,H2O和NH3分子之间也可形成氢键。某些分子内,例如HNO3、邻硝基苯酚分子可以形成分子内氢键,分子内氢键由于受环状结构的限制,X—H…Y往往不能在同一直线上。
㈢性质
氢键通常是物质在液态时形成的,但形成后有时也能继续存在于某些液态甚至气态物质之中。例如在气态、液态和固态HF中都有氢键存在。能够形成氢键的物质是很多的,如水、水合物、无机酸和某些有机化合物。氢键的存在,影响到物质的某些性质。
1.熔点、沸点
分子间有氢键的物质熔化或气化时,除了要克服纯粹的分子间作用力外,还必须提高温度,额外的提供一份能量来破坏分子间的氢键,故这些物质的熔点,沸点比同系列氢化物的熔点、沸点高。例如,熔点、沸点:HF>HI、H2O>H2Te、NH3>AsH3等。分子内生成氢键,熔点、沸点常降低。例如,有分子内氢键的邻硝基苯酚熔点(45℃)比有分子间氢键的间位熔点(96℃)和对位熔点(114℃)都低。
2.溶解度
在极性溶剂中,如果溶质和溶剂分子之间可形成氢键,溶质的溶解度增大。例如,HF、NH3在水中的溶解度比较大。
3.粘度
分子间有氢键的液体,一般粘度较大,例如甘油、磷酸、浓硫酸等多羟基化合物,由于分子间可形成众多的氢键,这些物质通常为粘稠状液体。
4.密度
液体分子间若形成氢键,有可能发生缔合现象,即通过氢键联系在一起的复杂分子,若干个简单分子连成复杂分子而又不会改变原物质化学性质,结果会影响液体的密度。例如,常温下液态水中除了简单水分子外,还有(H2O)n (n(为大于或等于)2的正整数),温度降低,有利于水分子的缔合。在0℃,全部水分子结成冰,水分子大范围以氢键相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,可浮于水面。
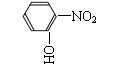
衔接练习:
1.分子内通过氢键又形成了一个六元环,用“结构式”表示硝基,用“…”表示氢键,画出上述分子的结构式 。
答案:
2.NH3·H2O的电离方程式为NH3·H2O ![]() NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是 (填序号)
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是 (填序号)
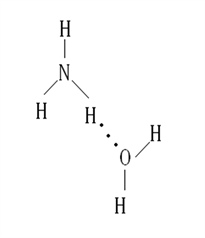
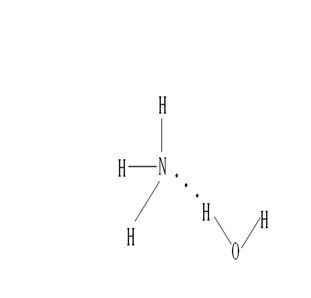
(A) (B)
答案:B
3.固态HF、HCl属于(填晶体类型名称) 晶体,其中沸点较高的是 ,导致这一结果的原因与产生下列情况的原因相同的是 (填选项代号)。
A、氨气容易液化
B、冰的密度小于液态水
C、干冰的熔点远小于二氧化硅
D、稳定性:NH3<H2O<HF
解析:固态的HF、HCl属于分子晶体,因为HF分子间形成氢键,熔点,沸点比同系列氢化物的熔点、沸点高。用氢键可以解释A、B,C中干冰的熔点远小于二氧化硅,是因为干冰是分子晶体而二氧化硅是原子晶体,C错误;D中稳定性:NH3<H2O<HF,稳定性和非金属性强弱有关,非金属性越强,氢化物越稳定,D错误。
答案:分子 HF AB
4.水分子间存在一种“氢键”的作用(作用力介于分子间作用力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被四个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体。
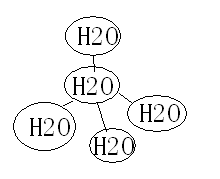
⑴1摩尔冰中有 摩尔氢键。
⑵水蒸气中常含有部分(H2O)2,要确定(H2O)2的存在,可采用的方法是 。
A.把1升水蒸气冷凝后与足量金属钠反应,测产生氢气的体积。
B.把1升水蒸气通过浓硫酸后,测浓硫酸增重的质量。
C.该水蒸气冷凝后,测水的pH。
D.该水蒸气冷凝后,测氢氧原子个数比。
⑶水分子可电离生成两种含有相同电子数的微粒,其电离方程式为: 。已知在相同条件下双氧水的沸点明显高于水的沸点,其可能原因是 。
⑷在冰的结构中,每个水分子与相邻的4个水分子以氢键相连接。在冰晶体中除氢键外,还存在范德华力(11千焦每摩尔)。已知冰的升华热是51千焦每摩尔,则冰晶体中每个氢键的能量是 。
解析:⑴水分子间的氢键如图所示,一个水分子周围有四个氢键,用分摊法可知平均每个水分子最多形成4×1/2=2个氢键。
⑵AB A中若有(H2O)2存在,产生氢气的体积增大;B中若有(H2O)2存在,浓硫酸增重的质量增加;C中是否有(H2O)2,水的pH不变;D中是否有(H2O)2,氢氧原子个数比都为2:1。
⑶H2O+ H2O![]() H3O++OH-双氧水的相对分子质量比水的相对分子质量稍大,但题中强调沸点明显高于水,因此可判断双氧水分子之间存在着更为强烈的氢键的作用。
H3O++OH-双氧水的相对分子质量比水的相对分子质量稍大,但题中强调沸点明显高于水,因此可判断双氧水分子之间存在着更为强烈的氢键的作用。
⑷20每个水分子最多形成2个氢键,冰升华时需要破坏氢键和范德华力。则冰晶体中每个氢键的能量是(51-11)/2=20千焦每摩尔。
答案:(1)2(2)AB(3)H2O+ H2O![]() H3O++OH-
H3O++OH-
双氧水分子之间存在着更为强烈的氢键的作用。(4)20千焦每摩尔

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。通常而言,同主族元素形成的X-X键,自上而下,键长逐渐增大,键能逐渐降低。 根据元素...
无机化学实验是一门与无机化学理论课密切配合的课程。实验用化学事实充实了理论课的学...
能否形成氢键的“视点”:一看有无电负性...
1mol 氨中氢键数量分析 一、氢键形成机制 NH分子结构 H原子作为氢键供体(需与高电负性...
二氧化氮(NO)中氮原子的杂化类型为 sp杂化,具体分析如下: 1.计算 n (的价层电子对数...
...