
|
学习小专题 |

|
学习小专题 |
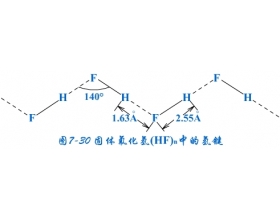 [探讨与扩展a] 氢键的形成、特点及对物质性质的影响 作者:陈万 来源:未知 日期:2016-01-24 17:54:09 点击:25411 所属专题:氢键02
[探讨与扩展a] 氢键的形成、特点及对物质性质的影响 作者:陈万 来源:未知 日期:2016-01-24 17:54:09 点击:25411 所属专题:氢键02
氢键是一种存在于分子之间也存在分子内部的作用力,它比化学键弱,又比范德华尔力强。 1、氢键的形成 在HF分子中,H和F原子以共价键结合,但因F原子的电负性大,电子云强烈偏向F原子一方,结果使H原子一端显正电性。由于H原子半径很小,又只有一个电子,当电子强烈地偏...
 [注解与辨疑e] σ键的形成 作者:毛远明 来源:未知 日期:2016-01-30 12:40:47 点击:6121 所属专题:σ键 共价键
[注解与辨疑e] σ键的形成 作者:毛远明 来源:未知 日期:2016-01-30 12:40:47 点击:6121 所属专题:σ键 共价键
原子轨道按头碰头的方式发生轨道重叠,轨道重叠的部分沿着键轴呈圆柱形对称,这种共价键称为键。键轴是指两原子核间的联线。可以对键轴呈圆柱形对称的轨道重叠形式有S-S轨道重叠(H 2 分子),S-P轨道重叠(HCl分子),Px-Px轨道重叠(Cl 2 分子)。它们都形成键。...
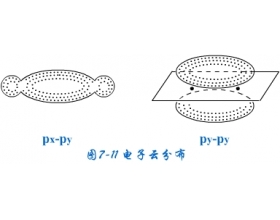 [注解与辨疑e] π键的形成 作者:张劲辉 来源:未知 日期:2023-05-10 14:49:30 点击:18090 所属专题:π键 共价键
[注解与辨疑e] π键的形成 作者:张劲辉 来源:未知 日期:2023-05-10 14:49:30 点击:18090 所属专题:π键 共价键
原子轨道按肩并肩的方式发生轨道重叠,轨道重叠部分对通过键轴的一个平面具有镜面反对称,这种共价键称为键。除p-p轨道可以重叠形成键外,p-d,d-d轨道重叠也可以形成键。 由于键对键轴呈圆柱形对称,所以电子云在两核之间密集,键对键轴平面呈镜面反对称,电子云在...
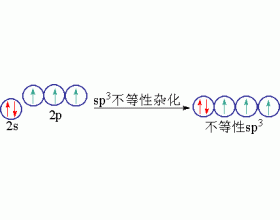 [注解与辨疑e] 不等性杂化轨道 作者:张扬 来源:未知 日期:2021-05-13 16:13:46 点击:7913 所属专题:杂化轨道类型
[注解与辨疑e] 不等性杂化轨道 作者:张扬 来源:未知 日期:2021-05-13 16:13:46 点击:7913 所属专题:杂化轨道类型
有些分子的成键,表面来看与CH 4 分子的成键差别很大。比如NH 3 分子的成键似乎与BF 3 分子类似,中心原子也将采取sp 2 杂化的方式成键,键角也应为120,但实测结果键角却为10718,与10928更为接近些。又譬如H 2 O分子的成键似乎与BeCl 2 分子类似,中心原子也将采取sp...
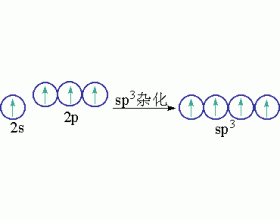 [注解与辨疑e] sp3杂化轨道 作者:刘洪林 来源:未知 日期:2013-04-13 18:51:50 点击:8315 所属专题:杂化轨道类型
[注解与辨疑e] sp3杂化轨道 作者:刘洪林 来源:未知 日期:2013-04-13 18:51:50 点击:8315 所属专题:杂化轨道类型
同一原子内由一个ns轨道和三个np轨道发生的杂化,称为sp 3 杂化,杂化后组成的轨道称为sp 3 杂化轨道。sp 3 杂化可以而且只能得到四个sp 3 杂化轨道。 CH 4 分子的结构经实验测知为正四面体结构,四个C-H键均等同,键角为10928,杂化轨道理论认为,激发态C原子(2s 1 2...
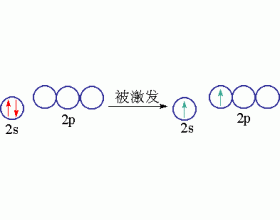 [注解与辨疑e] sp杂化轨道 作者:程波 来源:未知 日期:2013-04-13 18:06:20 点击:10644 所属专题:杂化轨道类型
[注解与辨疑e] sp杂化轨道 作者:程波 来源:未知 日期:2013-04-13 18:06:20 点击:10644 所属专题:杂化轨道类型
同一原子内由一个ns轨道和一个np轨道发生的杂化,称为sp杂化。杂化后组成的轨道称为sp杂化轨道。sp杂化可以而且只能得到两个sp杂化轨道。 实验测知,气态BeCl 2 是一个直线型的共价分子。Be原子位于两个Cl原子的中间,键角180,两个Be-Cl键的键长和键能都相等: Cl-Be-Cl...
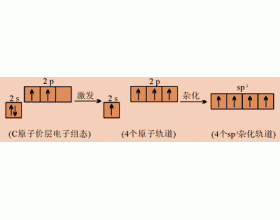
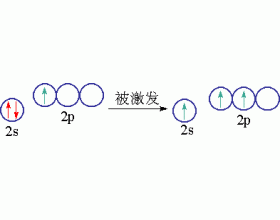 [注解与辨疑e] sp2杂化轨道 作者:罗翊轩 来源:未知 日期:2013-04-13 18:00:10 点击:12402 所属专题:杂化轨道类型
[注解与辨疑e] sp2杂化轨道 作者:罗翊轩 来源:未知 日期:2013-04-13 18:00:10 点击:12402 所属专题:杂化轨道类型
同一原子内由一个ns轨道和二个np轨道发生的杂化,称为sp 2 杂化。杂化后组成的轨道称为sp 2 杂化轨道。实验测知,气态氟化硼(BF 3 )具有平面三角形的结构。B原子位于三角形的中心,三个B-F键是等同的,键角为120。 基态B原子的价层电子构型为2s 2 2p 1 ,表面看来似乎只...
 [注解与辨疑e] 配位键和配位数 作者:黄勇 来源:未知 日期:2022-04-06 17:34:54 点击:28032 所属专题:配位键 配合物配位数
[注解与辨疑e] 配位键和配位数 作者:黄勇 来源:未知 日期:2022-04-06 17:34:54 点击:28032 所属专题:配位键 配合物配位数
配位键 定义:成键电子由成键原子一方单独提供形成的共价键,叫做配位键(曾用名:配价键)。 说明 1.配位键是特殊的共价键。常用L→M符号表示。其中L提供孤对电子,叫做电子对给予体。M原子有空轨道,可以接受孤对电子,叫做电子对接受体。 2.一方有孤对电子,而另一方...
 [注解与辨疑e] CCl4分子的空间构型 作者:丁萍 来源:未知 日期:2022-03-18 17:00:16 点击:22892 所属专题:四氯化碳 分子结构模型
[注解与辨疑e] CCl4分子的空间构型 作者:丁萍 来源:未知 日期:2022-03-18 17:00:16 点击:22892 所属专题:四氯化碳 分子结构模型
实验测定表明,CCl 4 分子的空间构型为正四面体。其形成过程可表示为示为 CCl 4 分子的空间构型和sp 3 杂化轨道 中心原子C以夹角均为109°28′的4个完全等同的sp 3 杂化轨道分别与4个H原子的1s轨道重叠后,形成4个sp 3 s的σ键。故CCl 4 分子的空间构型为正四面体。...
 [注解与辨疑e] 杂化轨道类型与分子空间构型的关系 作者:董啸 来源:未知 日期:2013-04-03 10:13:44 点击:38547 所属专题:杂化类型判断 分子立体结构判断
[注解与辨疑e] 杂化轨道类型与分子空间构型的关系 作者:董啸 来源:未知 日期:2013-04-03 10:13:44 点击:38547 所属专题:杂化类型判断 分子立体结构判断
一、sp 3 杂化——分子的空间构型为(正)四面体 以CH 4 为例 C原子外层电子构型(基态)C原子(激发态)C原子(杂化态) sp 3 杂化轨道的特点:sp 3 轨道夹角为109度28分,以正四面体结构排列,4个sp 3 轨道等同。 不等性sp 3 杂化——分子的空间构型为三角锥形或V型 以NH...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。1mol 氨中氢键数量分析 一、氢键形成机制 NH分子结构 H原子作为氢键供体(需与高电负性...
二氧化氮(NO)中氮原子的杂化类型为 sp杂化,具体分析如下: 1.计算 n (的价层电子对数...
...
【导读】 以下是快速判定氢键强弱的基本原则,实际案例中经常会进一步考虑综合因素的...
根据价电子互斥理论, ClO 2 中氯原子周围的价电子对数计算为 3.5,理论上应倾向于 sp...
【导读】分子间作用力(范德华力)的来源是取向力、诱导力和色散力。 ①一般情况下,极...
PH3与PF3两者中心原子杂化方式及孤对电子数都相同,F原子的电负性比H的电负性更大,P-...
硫氰根离子(SCN)与金属离子形成配位键时,硫原子和氮原子都有可能给出电子对。 当和一...