
|
学习小专题 |

|
学习小专题 |
 [探讨与扩展a] 决定共价键极性强弱的因素 作者:陈爱玉 来源:未知 日期:2012-12-03 10:57:50 点击:23356 所属专题:键的极性
[探讨与扩展a] 决定共价键极性强弱的因素 作者:陈爱玉 来源:未知 日期:2012-12-03 10:57:50 点击:23356 所属专题:键的极性
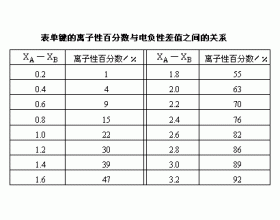
在共价化合物中形成弱极性键或强极性键是由哪些因素来决定的?电负性差值达到什么程度,极性键就转变为离子键? 在共价化合物中,由于不同元素的原子吸引电子的能力不同,共用电子对就必然或多或少地偏向于对它吸引力较大的那个原子(即电子云密度大的地方将偏近于这个...
 [注解与辨疑e] 分子结构规律——最大对称原理 作者:黄惠 来源:未知 日期:2022-12-08 16:45:16 点击:41685 所属专题:分子空间结构判断
[注解与辨疑e] 分子结构规律——最大对称原理 作者:黄惠 来源:未知 日期:2022-12-08 16:45:16 点击:41685 所属专题:分子空间结构判断
化合物中的中心原子周围的电子对之间总是尽可能最大角度地对称分布,因为共用电子之间的角度越大,对称性越高,它们之间的同性排斥力就必然越小,这样分子就必然越稳定。这个规律不妨叫做最大对称原理。 只有当中心原子周围的电子对(或共价键)相同时,它们才可能最大...
 [注解与辨疑a] 氢键中的两个问题集 作者:徐俊龙 来源:浙江省慈溪市观城中学 日期:2024-03-13 08:36:00 点击:9438 所属专题:氢键与熔沸点
[注解与辨疑a] 氢键中的两个问题集 作者:徐俊龙 来源:浙江省慈溪市观城中学 日期:2024-03-13 08:36:00 点击:9438 所属专题:氢键与熔沸点
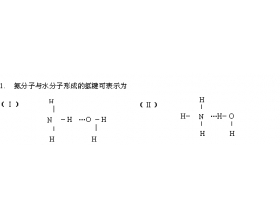
1. 为什么 HF 分子间氢键比 H 2 O 分子间氢键强,而 HF 的沸点却比 H 2 O 的低? 由于氟原子半径比氧原子小,电负性大于氧,所以 HF 分子间的 F - H … F 氢键比 H 2 O 分子间的 O — H … O 氢键要强得多,前者键能为 28KJ/mol, 后者 18.8KJ/mol 。即使在气态时, HF ...
 [注解与辨疑e] 共价键知识与规律 作者:李浩 来源:未知 日期:2012-12-03 11:08:56 点击:10621 所属专题:共价键
[注解与辨疑e] 共价键知识与规律 作者:李浩 来源:未知 日期:2012-12-03 11:08:56 点击:10621 所属专题:共价键
一、共价键本质与分类 1. 共价键的概念:原子间通过共用电子对所形成的相互作用叫做共价键。共价键的本质 是原子之间形成共用电子对。 评注 :通常电负性相同或差值小的非金属原子形成的化学键为共价键,当两原子的电负性相值差大,形成的是离子键。 2. 共价键的分类 根...
 [注解与辨疑e] 价层电子对互斥理论的应用 作者:姚小伟 来源:未知 日期:2020-01-02 08:36:15 点击:9022 所属专题:价层电子对互斥理论
[注解与辨疑e] 价层电子对互斥理论的应用 作者:姚小伟 来源:未知 日期:2020-01-02 08:36:15 点击:9022 所属专题:价层电子对互斥理论
价键理论可解释原子采用什么样的空间轨道去形成共价键,但不易预测分子的空间结构。价层电子对互斥理论可相当成功地简便地判断许多共价型分子的几何构型。 该理论认为,在多原子共价型分子中,中心原子周围的配体(原子、离子或原子团)的相对几何位置,决定于中心原子的...
 [探讨与扩展a] 化学键疑难点拨 作者:张澳 来源:未知 日期:2012-12-03 11:02:48 点击:14660 所属专题:化学键
[探讨与扩展a] 化学键疑难点拨 作者:张澳 来源:未知 日期:2012-12-03 11:02:48 点击:14660 所属专题:化学键
1 .怎样认识化学键的极性和分子的极性 元素形成单质或化合物时,在邻近两个或多个原子之间的,主要的、强烈的相互作用叫化学键。一般来说,活泼金属和活泼非金属以离子键相结合。离子键没有方向性和饱和性。由离子键形成的化合物称离子化合物。在离子化合物中还可能存在...
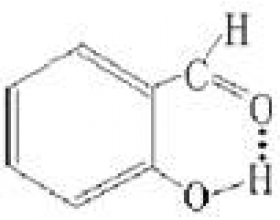 [探讨与扩展a] 谈谈氢键 作者:王利平 来源:未知 日期:2014-01-17 14:36:18 点击:18026 所属专题:氢键02
[探讨与扩展a] 谈谈氢键 作者:王利平 来源:未知 日期:2014-01-17 14:36:18 点击:18026 所属专题:氢键02
我们知道,结构相似的同系列物质的熔、沸点一般随着其分子量的增大而升高,按此推测, HF 、 H 2 O 、 NH 3 的沸点应比 HCl 、 H 2 S 、 PH 3 更低,但实际上却高得多,这种反常现象说明了 HF 、 H 2 O 、 NH 3 分子之间存在较大的作用力,人们把这种作用力称为“氢键”...
 [注解与辨疑e] 配位化合物的命名 作者:黄瑞 来源:未知 日期:2012-12-03 11:06:39 点击:13237 所属专题:配合物 无机物命名
[注解与辨疑e] 配位化合物的命名 作者:黄瑞 来源:未知 日期:2012-12-03 11:06:39 点击:13237 所属专题:配合物 无机物命名
配位化合物组成较复杂,需按统一的规则命名.根据1980年中国化学会无机专业委员会制订的汉语命名原则.简要介绍如下. 整个配合物的命名 整个配合物的命名与无机物命名规则相同,如果配合物中的酸根是一个简单的阴离子,则称为某化某;如果酸根是一个复杂的阴离子,则称为某酸某...
 [探讨与扩展6] 铜盐溶液的颜色为何不都是蓝色 作者:张红 来源:未知 日期:2019-04-03 15:52:16 点击:9358 所属专题:氯化铜 铜的配合物
[探讨与扩展6] 铜盐溶液的颜色为何不都是蓝色 作者:张红 来源:未知 日期:2019-04-03 15:52:16 点击:9358 所属专题:氯化铜 铜的配合物
在高中化学演示实验中,有三个实验涉及到铜盐溶液的颜色。实验者往往会观察到铜盐溶液的颜色并非都是蓝色的,这是什么原因呢? 一、氯化铜溶液的颜色 在氯气的性质实验中,铜丝在氯气中燃烧后,在集气瓶中加入少量水,用玻璃片盖住瓶口,振荡。瓶内溶液的颜色有时会呈蓝...
 [注解与辨疑e] 等电子原理 作者:关平 来源:未知 日期:2012-12-03 11:09:21 点击:13026 所属专题:等电子体
[注解与辨疑e] 等电子原理 作者:关平 来源:未知 日期:2012-12-03 11:09:21 点击:13026 所属专题:等电子体
1 、等电子原理 1919 年,美国化学家 Irving Langmuir 在大量实验事实的基础上总结出一条经验规律,即等电子原理:原子数相同,电子数相同的分子,结构相似,物理性质相近。具有等电子特征的微粒互称为等电子体。常见的等电子体如N 2 和CO,其性质比较如表1。 表 1CO 与...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。1mol 氨中氢键数量分析 一、氢键形成机制 NH分子结构 H原子作为氢键供体(需与高电负性...
二氧化氮(NO)中氮原子的杂化类型为 sp杂化,具体分析如下: 1.计算 n (的价层电子对数...
...
【导读】 以下是快速判定氢键强弱的基本原则,实际案例中经常会进一步考虑综合因素的...
根据价电子互斥理论, ClO 2 中氯原子周围的价电子对数计算为 3.5,理论上应倾向于 sp...
【导读】分子间作用力(范德华力)的来源是取向力、诱导力和色散力。 ①一般情况下,极...
PH3与PF3两者中心原子杂化方式及孤对电子数都相同,F原子的电负性比H的电负性更大,P-...
硫氰根离子(SCN)与金属离子形成配位键时,硫原子和氮原子都有可能给出电子对。 当和一...