
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
存在有缺项的化学方程式的配平,有两项任务:即填缺项代表的物质和配平,其难度又比一般化学方程式的配平高了一层。这类配平又有两种题型:一是缺项所代表的物质不参加氧化还原反应,即所含元素没有化合价的变化。这是目前最主要的题型,这类问题填缺项物质原则是:
① 一般作为反应物是介质:酸、碱、水,不参加氧化还原反应。
② 若果在酸性或碱性介质中反应,作为生成物则为水。
③ 缺什么,补什么。先看元素种类,若无所缺元素,则化合价升降后看原子个数的差。
另一类是缺项所代表的物质要参加氧化还原反应,且是生成物,那末要看缺项物质是氧化产物还是还原产物,对应的还原剂或氧化剂是什么,它在该反应中会变成什么氧化产物或还原产物。这就必须熟悉物质发生氧化还原反应的规律。如,一般情况下,浓硝酸与金属反应生成NO2,稀硝酸与金属反应生成NO。
例1:配平:
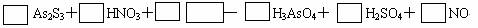
解析:显然,左边少H、O,应有水。稀HNO3被还原为NO,此式合理。
As2S3+ HNO3+H2O — H3AsO4+H2SO4+NO
As2S3和HNO3标准物,可以用化合价升降一次配平。
3As2S3+28HNO3+4H2O = 6H3AsO4+9H2SO4+28NO
例2:配平:

解析:显然,左边缺Cl元素,作为酸性介质应是HCl。
(NH4)2MnO4+Zn+ HCl — MnCl3+ZnCl2+NH4Cl+ H2O
(NH4)2MnO4和Zn,可以用化合价升降一次配平。
2(NH4)2MnO4+3Zn+16HCl = 2MnCl3+3ZnCl2+4NH4Cl+8H2O
例3:现有反应的化学方程式为:a FeCl2+b kNO3+c HCl=d FeCl3+e KCl+f X+g H2O,若b=1,d=3,X为生成物,其分子式应为 (C)
A. NH4Cl B. NO2 C. NO D. N2
解析:这是上面所说的第二种题型,但安排为选择题,确定缺项物质的分子式或化学式。可根据氧化还原反应方程式的配平原理,以及化合价的变化来求出物质的分子式或化学式。
A=D=3,3FeCl2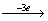 3FeCl3,1KNO3
3FeCl3,1KNO3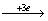 ?,根据电子得失数相等知为+2价氮,即NO。故此题不需找出全部系数,即可找出答案。
?,根据电子得失数相等知为+2价氮,即NO。故此题不需找出全部系数,即可找出答案。
下面是可供练习的问题:
(1) KMnO4+KNO2+[ ] — MnsO4+K2SO4+KNO3+H2O (MCe90·31)
(2) Pt+ HNO3+HCl — H2PtCl6+NO-+ [ ] (MCe91·34)
(3) 完成并配平下列方程式:
KIx+ Cl2+H2O= KCl+ HIO3+
若KIx与Cl2的化学计量数之比为1∶8,则x值为 。
答:(1) 2KMnO4+5KNO2+3[H2SO4]=2MnsO4+1K2SO4+5KNO3+3H2O
(2) 3Pt+4HNO3+18HCl=3H2PtCl6+4NO-+8[H2O]
(3) 2, 5x+1, 6x, 2, 2x, 10x HCl;3

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
说明: 1.不同于大学所说的“氧化数”,高中所学的“化合价”...
氧化还原反应的很多规律,如化合价有升必有降、电子有得必有...
配平氧化还原反应方程式的基本方法相同,关键是针对具体的反...
氧化性、还原性的强弱主要取决于物质本身得失电子的难易程度...
得失电子守恒是氧化还原反应的核心,根据这一原理,既可配平...
1 问题的提出 “氧化还原反应”在中学化学知识中占据着关键性...