
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、仪器——分液漏斗
1.仪器图片
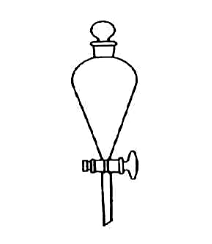
2.用途:用于两种不相溶液体的分离提纯
3.使用方法(以碘溶液和四氯化碳溶液为例))
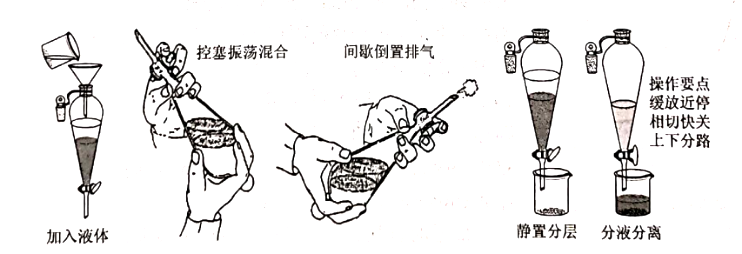
(1)检漏:关闭分液漏斗的活塞,打开上口的玻璃塞,往分液漏斗中注入适量水,盖紧上口玻璃塞。把分液漏斗垂直放置,观察活塞周围是否漏水。再用右手压住分液漏斗上口玻璃塞部分,左手握住活塞部分,把分液漏斗倒转,观察上口玻璃塞是否漏水,用左手转动活塞,看是否灵活。
(2)装液:用量简量取XXmL碘的饱和水溶液,倒入分液漏斗,然后再注入XXmL四氯化碳,盖好玻璃塞。
(3)震荡:用右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡,使两种液体充分接触;振荡后打开活塞,使漏斗内气体放出
(4)萃取:将分液漏斗放在铁架台上,静置待液体分层。
(5)分液:分离液体时,下层液体从漏斗下端管口放出,上层液体由上口倒出
4.注意事项
(1)分液漏斗的颈部有一个活塞,这是它区别于普通漏斗及长颈漏斗的重要原因,因为普通漏斗和长颈漏斗的颈部没有活塞,它不能灵活控制液体。分液漏斗在使用前要将漏斗颈上的旋塞芯取出,涂上凡士林,但不可太多,以免阻塞流液孔。
(2)将分液漏斗插入塞槽内转动使油膜均匀透明,且转动自如。然后关闭旋塞,往漏斗内注水,检查旋塞处是否漏水,不漏水的分液漏斗方可使用。
(3)使用时,左手虎口顶住漏斗球,用拇指食指转动活塞控制加液。此时玻璃塞的小槽要与漏斗口侧面小孔对齐相通,才便加液顺利进行。当分液漏斗中的液体向下流时,活塞可控制液体的流量,若要终止反应,就要将活塞紧紧关闭,因此,可立即停止滴加液体。
(4)放液时,磨口塞上的凹槽与漏斗口颈上的小孔要对准,这时漏斗内外的空气相通,压强相等,漏斗里的液体才能顺利流出。分液时根据“下流上倒”的原理,打开活塞让下层液体全部流出,关闭活塞。上层从上口倒出。分液漏斗不能加热。漏斗用后要洗涤干净。
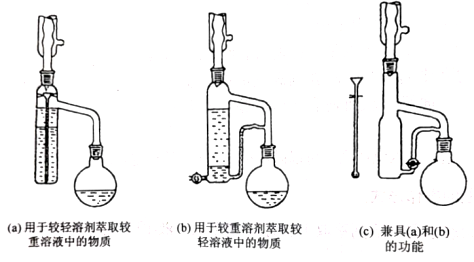
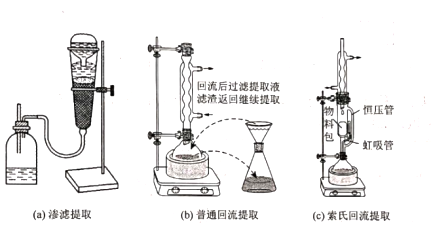
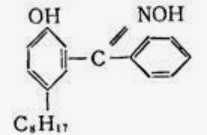
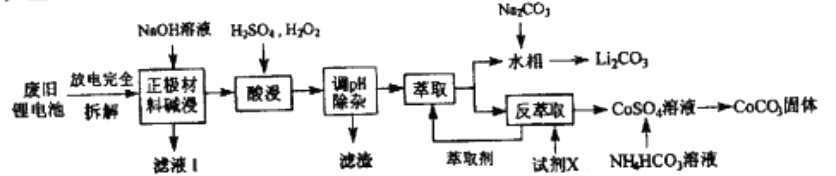
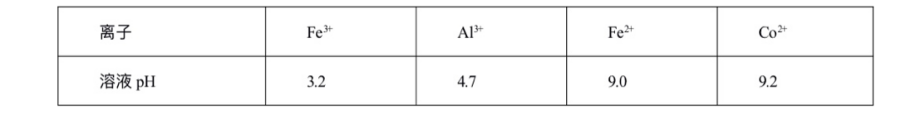
二、萃取的原理与操作方式 1.基本概念 萃取是利用各组分之间在两种不相混溶的相态中溶解度的差异,使其中的某一种或某几种组分从原来的相态中转移到另外一种溶解度更大的相态中,进而实现分离与纯化的一种实验技术和方法。按照两种相态的不同,萃取可分为固-液萃取、液-液萃取、气-液萃取等。在化学实验中,所选的另外一种相态通常为某种溶剂,这种萃取又被称为溶剂萃取。有时,为了更好地实现物质的相态转移,常加入某些化学试剂,通过一定的化学反应改变某种物质在两种相态中的溶解行为,这种萃取称为化学萃取,所加入的化学试剂称为萃取剂。 2.溶剂萃取法的相关原理 (1)萃取体系的基本构成:由被萃取相(固、液、气态的待分离混合物)和萃取溶剂相组成。如下图所示,中学常见萃取即为此类。 (2)溶剂萃取的基本原理:萃取是使被萃取物从原来的相态转移到溶解度更大的另一种相态的过程。依靠被萃取物在两相态间溶解性不同实现转移的萃取称为物理萃取。若被萃取物在萃取溶剂中溶解度不理想,可通过加入萃取剂使之与被萃取物发生化学反应,改变萃取物的结构形式和溶解性质,这种借助于化学反应而实现的萃取称为化学萃取。除收到溶解度影响外,还会受到两相溶液的组成、pH、温度等其他条件的影响。 3.萃取溶剂与萃取剂的选择 结合萃取过程和结果的其他因素。理想萃取剂应该满足的条件有: (1)与原溶剂互不相溶; (2)与原溶剂及溶质都不反应; (3)溶质在萃取剂中的溶解度要远大于其在原溶剂中的溶解度。 4.溶剂萃取的操作形态 溶剂萃取的操作形式按被萃取相态不同,溶剂萃取主要有液-液萃取、液-固萃取和液-气萃取三种形式。 (1)液-液溶剂萃取——高中常见萃取 ①间歇式:适合在不同相之间溶解度差异较大的物质的萃取。 ②连续式:适合在不同相之间溶解度差异较大的物质的萃取,需大量萃取溶剂分多次萃取才能达到萃取目的。取间歇萃取则会十分麻烦,可以采用连续式萃取。 (2)液-固溶剂萃取 液固萃取是用萃取溶剂萃取固体材质中某些化学成分的一种溶剂萃取形式,也称为溶剂提取法。常见的固体材料主要有植物材料、动物材料或矿物材料。此法在医药、生物、食品、矿产、环保等许多行业和研究领域都有实际应用,尤其在天然药物和生物医药方面应用更加广泛,如中草药有效成分的提取分离、生物样品中活性物质的提取分离等。 液固萃取的主要方法有浸泡提取、渗滤提取、回流提取、索氏回流提取等,如下图所示 (3)液-气溶剂萃取 气态物料中的物质,多以蒸气或气溶胶的形式存在,如大气中的有机物、烟气中的有机物等。这些气体中物质提取常采用固体吸附法,但也可用溶剂萃取法,即液0气萃取。其做法是选合适的溶剂,让气体样品通过溶剂,溶剂将有机物溶解并吸收。 5.高考题型 (2021·浙江高考真题)Cl2O是很好的氯化剂,实验室用如图装置(夹持仪器已省略)制备高纯Cl2O。已知: ①HgO+2Cl2=HgCl2+Cl2O,合适反应温度为18~25℃;副反应: ②常压下Cl2沸点-34℃,熔点;-101.0℃,Cl2O沸点2.0℃,熔点-120.6℃。 ③ 请回答: 将纯化后的Cl2O产品气化,通入水中得到高纯度Cl2O的浓溶液,于阴凉暗处贮存。当需要Cl2O时,可将Cl2O浓溶液用CCl4萃取分液,经气化重新得到。 针对萃取分液,从下列选项选择合适操作(操作不能重复使用)并排序:C→____A___→____B___→E→D→F→____G___。 A.检查旋塞、玻璃塞处是否漏水 B.将溶液和转入分液漏斗 C.涂凡士林 D.旋开旋塞放气 E.倒转分液漏斗,小心振摇 F.经几次振摇并放气后,将分液漏斗置于铁架台上静置 G.打开旋塞,向锥形瓶放出下层液体 H.打开旋塞,待下层液体完全流出后,关闭旋塞,将上层液体倒入锥形瓶 三、萃取的延展应用 1.萃取法:萃取法也可用于金属元素的分离和富集。 萃取剂主要在有色金属湿法冶金行业应用广泛,比如铜、锌、钴镍、镉、金银、铂系金属、稀土等行业。 金属萃取剂主要是一些常见的如磷酸、铵盐、苯等七种的氢离子或者羟基被一些长链烷基给取代。金属与这些萃取剂结合,就会变成金属有机化合物,而溶解于有机溶剂中。由于各种金属与这些萃取剂的结合能力不同,而导致这些萃取剂萃取金属的顺序不同,从而分离这些金属离子。 金属萃取剂萃取原理:利用两种互不相溶互不反应(微溶)的溶剂中溶解度或分配系数的不同,使化合物从一种溶剂内转移到另外一种溶剂中。经过反复多次萃取,将绝大部分的化合物提取出来。 无机离子一般易溶于水相,有机物易溶于有机相。比如说,氯离子,钙离子等都易溶于水,脂类易溶于丙酮或者醚类(乙醚石油醚)。有机相溶于醇类,但醇类中含有氢键有易溶于水。 溶剂萃取是基于有机溶剂对不同的金属离子具有不同的溶解因而对溶液中的金属离子可以进行富集与分离。例如含有机剂的有机相与含有金属离子的溶液相(也称水相)互相接触时,由于金属离子在两相中的溶解度不同而重新分配,从而实现一种金属在有机相中的富集并与其他杂质分离。 现以一种名为N-510的萃取剂对含铜溶液的萃取为例,来说明萃取的机理。N-510为羟肟型萃取剂,全名叫2羟基-5仲辛基二甲苯甲酮肟,分子量为325。结构式为: 萃取时,它能与铜离子生成金属鳌合物,使铜被萃取,并析出氢离子。其反应可用下式表示:Cu2+(水相)+2Rh(有机相)CuR(有机相)+2H+(水相) 上式反应是可逆的,在弱酸性介质中,由于反应生成的金属螯合物稳定性好,反应向右进行,即萃取反应。在强酸性介质中,上述反应向左进行,即鳌合物的金属离子将会由有机相转入水相,有机相能获得再生,这叫“反萃取”反应。 2.反萃取 (1)将富集在四氯化碳中的碘单质利用化学转化法重新富集在水中的方法即为反萃取法。 (2)反萃取的作用: 反萃取可将有机相中各个被萃组分逐个反萃到水相,使被分离组分得到分离;也可一次将有机相中被萃组分反萃到水相。经过反萃取及所得反萃液经过进一步处理后,便得到被分离物的成品。反萃后经洗涤不含或少含萃合物的有机相称再生有机相,继续循环使用。 3.高考题型 钻酸锂电池成用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑。铝箔及少量Fe,可通过下列实验方法回收钴、锂。 几种金属离子沉淀完全(离子浓度为10-5mol/L)的pH如下表: 回答下列问题: “萃取”和“反萃取“可简单表示为: Co2++2(HA)2Co(HA2)2+2H+则反萃取过程加入的试剂X是H2SO4溶液。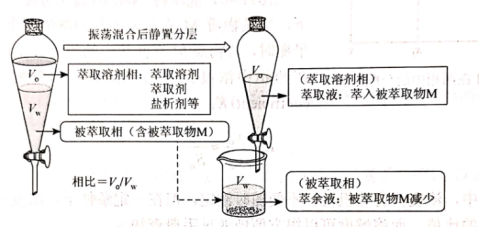
![]() 。
。![]() ,Cl2O在CCl4中的溶解度远大于其在水中的溶解度。
,Cl2O在CCl4中的溶解度远大于其在水中的溶解度。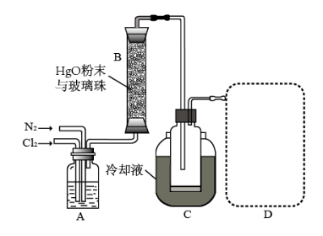


 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。“减压,能降低大部分物质的熔沸点,通过减压,可以在加热蒸发、蒸馏、过滤的时候减少...
参考答案: 1)不能;2)吸收Cl2、防止空气中的水蒸气进入体系;3)三颈烧瓶,b,减压...
一、结晶 1、结晶的概念: 是物质从无序状态(如溶液、熔融态或气态)中,通过分子、...
“减压,能降低大部分物质的熔沸点,通过减压,可以在加热蒸发、蒸馏、过滤的时候减少...
萃取,顾名思义,“提取其精粹”之含义。有“液-液”萃取和“固-液”萃取之分。 “...
一、水蒸气蒸馏 : 1、原理: 水蒸气蒸馏分离纯化有机物的重要方法之一,对于不溶于水...