
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
Fe3++(n)SCN- [Fe(SCN)n](3-n)
[Fe(SCN)n](3-n)
从Fe3+和SCN-反应的离子方程式可以看出,K+和Cl-都没有参加反应,加入KCl不会引起Fe3+/SCN-平衡的移动。事实上,加入NaNO3、CH3COONH4、Na2SO4或KI等这些与平衡无关的强电解质晶体,都会使Fe3+/SCN-溶液的颜色变浅。这种颜色的变化不是由于平衡的移动,而是由于“盐效应”引起的。
往弱电解质的溶液中加入与弱电解质没有相同离子的强电解质时,由于溶液中离子总浓度增大,离子间相互牵制作用增强,使得弱电解质解离的阴、阳离子结合形成分子的机会减小,从而使弱电解质分子浓度减小,离子浓度相应增大,解离度增大,这种效应称为盐效应(Salt Effect)。当溶解度降低时为盐析效应(Saltingout);反之为盐溶效应(Saltingin)。
可以解释如下:
在[Fe(SCN)]2+溶液里,存在着下列电离平衡:
Fe3++SCN- [Fe(SCN)]2+
[Fe(SCN)]2+
当加入强电解质后,大大增加了溶液中离子的浓度,增大了离子间的相互作用。
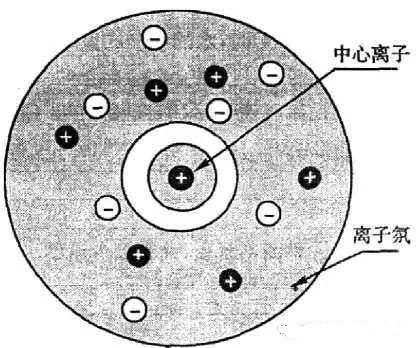
阳离子周围形成阴离子氛,阴离子周围形成阳离子氛。由于离子的不断运动,这些离子氛时而拆散时而形成,使溶液里离子之间牵制作用增强,使Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,也就是说,[Fe(SCN)]2+电离度增大,使溶液的红色变浅。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。Fe 3+ +(n)SCN - Fe(SCN)n (3-n) 从Fe 3+ 和SCN - 反应的离子方程式可以看出,K ...
在中学化学教学中,常会碰到这样的习题: 某研究性学习小组做铝与酸反应的实验,发现H...
从Fe 3+ 和SCN - 反应的离子方程式可以看出,K + 和Cl - 都没有参加反应,加入KCl不会...
问题:向平衡体系FeCl 3 + 3KSCN Fe(SCN) 3 + 3KCl中加人KCl固体,究竟能否影响该化...
【原理】亚甲蓝(C16H18ClN3S3H2O2分子量373.90)是噻嗪衍生物,用作观察细菌和组织切...