
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
结合图像分析电离平衡、水解平衡、溶解平衡,判断离子浓度的关系是全国卷考查的重点,常考图像类型总结如下:
1.一强一弱溶液的稀释图像
(1)相同体积、相同浓度的盐酸、醋酸
|
|
加水稀释相同的倍数,醋酸的pH大 | 加水稀释到相同的pH,盐酸加入的水多 |
(2)相同体积、相同pH的盐酸、醋酸
|
|
加水稀释相同的倍数,盐酸的pH大 | 加水稀释到相同的pH,醋酸加入的水多 |
(3)pH与稀释倍数的线性关系
|
|
| |
①HY为强酸、HX为弱酸 ②A、B两点的溶液中:c(X-)=c(Y-) ③水的电离程度:d>c>a=b | ①MOH为强碱、ROH为弱碱 ②c(ROH)>c(MOH) ③水的电离程度:a>b |
2.双曲线型[K=c(X+)·c(Y-)]
不同温度下水溶液中c(H+)与c(OH-)的变化曲线 | 常温下,CaSO4在水中的沉淀溶解平衡曲线[Ksp=9×10-6] |
|
|
(1)A、C、B三点均为中性,温度依次升高,Kw依次增大 (2)D点为酸性溶液,E点为碱性溶液,Kw=1×10-14 (3)AB直线的左上方均为碱性溶液,任意一点:c(H+)<C(OH-) | (1)a、c点在曲线上,a→c的变化为增大c(SO42-),如加入Na2SO4固体,但Ksp不变 (2)b点在曲线的上方,Qc>Ksp,将会有沉淀生成 (3)d点在曲线的下方,Qc<Ksp,则为不饱和溶液,还能继续溶解CaSO4 |
3.直线型(双曲线转化为直线)
(1)常考有关对数举例
①pC:类比pH,即为C离子浓度的负对数,规律是pC越大,C离子浓度越小。
②pK:平衡常数的负对数,规律是pK越大,平衡常数越小,对于一元弱酸(HX):pKa=pH-lg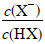 ,lg
,lg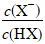 越大,HX的电离程度越大。
越大,HX的电离程度越大。
③AG=lg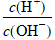 ,氢离子浓度与氢氧根离子浓度比的对数;规律是:AG越大,酸性越强,中性时AG=0。
,氢离子浓度与氢氧根离子浓度比的对数;规律是:AG越大,酸性越强,中性时AG=0。
(2)常考有关图像举例
①pOH-pH曲线:
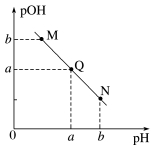
A.表示一元酸与一元碱中和过程中H+与OH-离子浓度的关系。
B.Q点代表中性。
C.M点显酸性,N点显碱性,两点水的电离程度相同。
②直线型(pM-pR曲线)
pM为阳离子浓度的负对数,pR为阴离子浓度的负对数
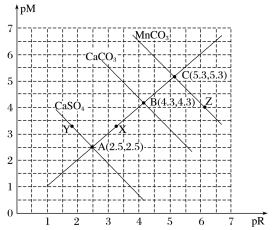
A.直线AB上的点:c(M2+)=c(R2-);
B.溶度积:CaSO4>CaCO3>MnCO3;
C.X点对CaCO3要析出沉淀,对CaSO4是不饱和溶液,能继续溶解CaSO4;
D.Y点:c(SO42-)>c(Ca2+),二者的浓度积等于10-5;Z点:c(CO32-)<c(Mn2+),二者的浓度积等于10-10.6。
解答沉淀溶解平衡图像题的注意事项
(1)溶液在蒸发时,离子浓度的变化分两种情况:
①原溶液不饱和时,离子浓度都增大;
②原溶液饱和时,离子浓度都不变。
(2)溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关,在同一曲线上的点,溶度积常数相同。
(3)对于沉淀溶解平衡状态的体系,若温度不变时,无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线以外。
③常温下将KOH溶液滴加到二元弱酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系图
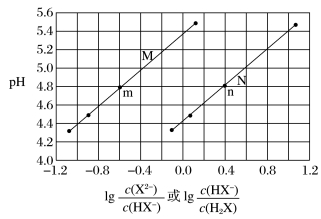
A.二元弱酸(H2X)一级电离程度远大于二级电离程度。
lg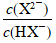 越大,表示电离程度越大,因而N代表一级电离的曲线,M代表二级电离曲线。
越大,表示电离程度越大,因而N代表一级电离的曲线,M代表二级电离曲线。
B.可以根据M点,N点的坐标计算pKa1和pKa2。
4.酸碱中和滴定曲线
氢氧化钠滴定等浓度等体积的盐酸、醋酸的滴定曲线 | 盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线 |
|
|
曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高 | |
突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应) | |
室温下pH=7不一定是终点:强碱与强酸反应时,终点是pH=7;强碱与弱酸(强酸与弱碱)反应时,终点不是pH=7(强碱与弱酸反应终点是pH>7,强酸与弱碱反应终点是pH<7) | |
巧抓“四点”,突破反应过程中“粒子”浓度的关系
(1)抓反应“一半”点,判断是什么溶质的等量混合。
(2)抓“恰好”反应点,生成什么溶质,溶液的酸碱性,是什么因素造成的。
(3)抓溶液“中性”点,生成什么溶质,哪种反应物过量或不足。
(4)抓反应“过量”点,溶质是什么,判断谁多、谁少还是等量。
5.分布系数图及分析[分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线]
一元弱酸(以CH3COOH为例) | 二元酸(以草酸H2C2O4为例) |
|
|
δ0为CH3COOH分布系数,δ1为CH3COO-分布系数 | δ0为H2C2O4分布系数,δ1为HC2O4-分布系数,δ2为C2O42-分布系数 |
随着pH增大,溶质分子浓度不断减小,离子浓度逐渐增大,酸根离子增多。根据分布系数可以书写一定pH时所发生反应的离子方程式 | |
同一pH条件下可以存在多种溶质微粒。根据在一定pH的微粒分布系数和酸的分析浓度,就可以计算各成分在该pH时的平衡浓度 | |

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。双指示剂法是一种利用两种具有不同变色范围的酸碱指示剂,在滴定过程中分别指示两个不...
弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生成 CuS 黑色沉淀和 ...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明怎样计算由水电离产生...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常数的计算、弱酸的相对强弱...
...