
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
原子晶体、金属晶体、离子晶体,构成它们的原子或离子都以紧密排列的方式挨在一起,只要知道了原子或离子的排列方式和半径,就可以计算出晶胞中原子或离子的空间利用率,也可以计算出晶体的密度。
但分子晶体不同,分子之间并不是紧挨在一起,所以它们的空间利用率和密度,还需要知道分子的间距或晶胞的边长等,才能计算。
一、空间利用率的计算
1、空间利用率的计算式

若原子的半径为R,晶胞中原子有n个,立方晶胞的边长为a:
单个原子的体积为4πr3/3,立方晶胞的体积为a3。
则空间利用率为
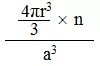
2、各种晶胞的空间利用率计算
(1)金属晶体的简单立方
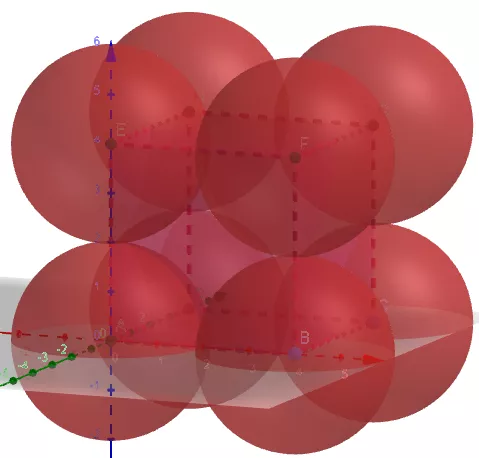
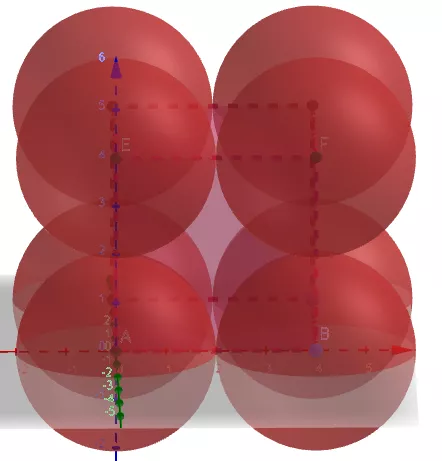
①晶胞中原子数目计算:8×1/8=1。
②空间利用率计算:设球的半径为r,则正方体的边长为2r。
原子的总体积为4πr3/3。正方体的体积为8r3。
空间利用率为
(4πr3/3)/(8 r3)=π/6=52.36%
(2)金属晶体的体心立方
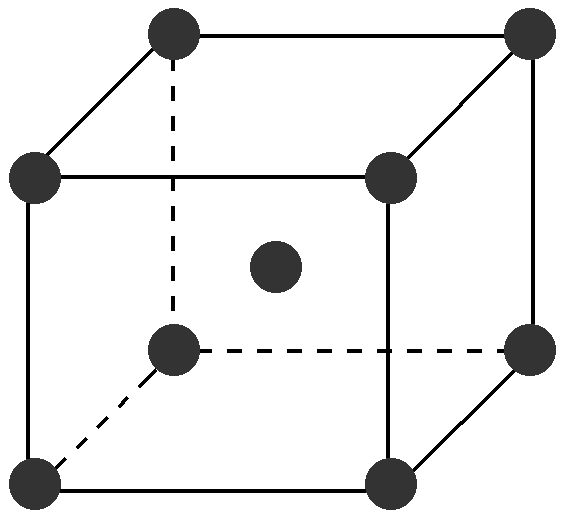
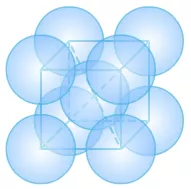
①晶胞中的原子数目计算:8×1/8+1=2。
②空间利用率计算:在体心立方中,设为球半径为r,
则正方体的体对角线为4r。
又因为正方体的体对角线是边长的√3倍,则边长为4r /√3。
原子的总体积为2×4πr3/3,正方体的体积为64r3/3√3。
空间利用率为(2×4πr3/3)/(64r3/3√3)=π√3/8= 68.02%
(3)金属晶体的六方堆积
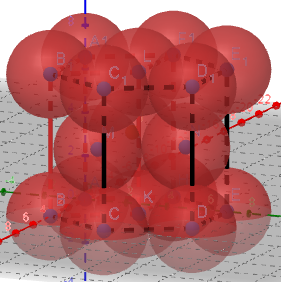
左图的粉色区域代表一个晶胞
由于1个正六棱柱相当于3个晶胞,所以用六棱柱的1/3进行计算。
①正六棱柱中原子数目计算:12×1/6+2×1/2+3=6。
则晶胞中的原子数目为6×1/3=2。
②空间利用率计算:设球的半径为r,则面上正六边形的边长为2r。
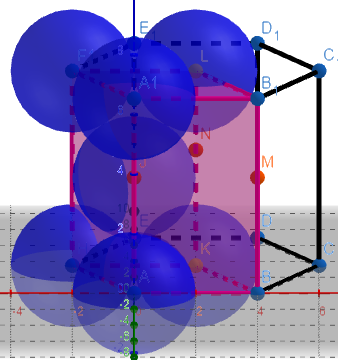
正六棱柱的高的计算:
正六棱柱的高为两个边长为2r的正四面体的高。边长2r的正四面体的体高为2√6r/3,则正六棱柱的高为4√6r/3。
正六边形的面积为6×√3r2=6√3r2。
正六棱柱的体积为(6√3r2)×(4√6r/3)=24√2 r3。
晶胞体积为正六棱柱的1/3,为8√2r3。
原子的总体积为2×4πr3/3=8πr3/3。
空间利用率为(8πr3/3)/(8√2r3)=π/3√2= 74.05%
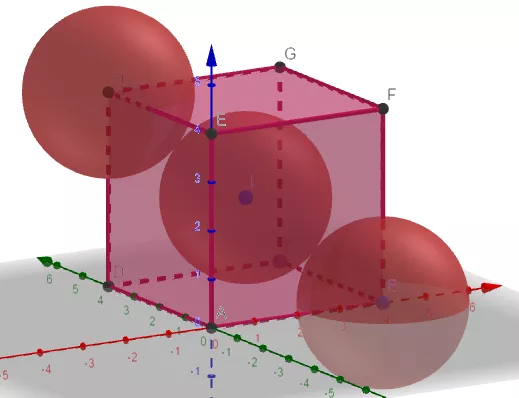
(4)金刚石原子晶体的结构
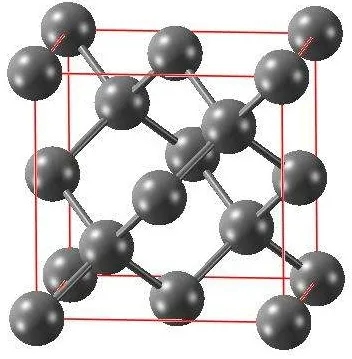
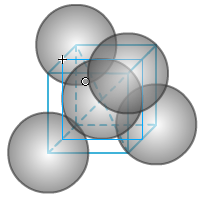
①晶胞中的原子数目计算:8×1/8+6×1/2+4=8
②空间利用率计算:根据两个C之间紧密相邻,若C的原子半径为r,则C-C为2r。
大立方体切8个小立方体,其中一个如右图。中间球位于小立方体的中心。小立方体的体对角线为4r(自己思考一下),则小立方体的边长为4r/√3。
求得大立方体的边长为8r/√3,体积为512r3/3√3。
大立方体内的碳原子数为8,碳原子的总体积为8×4πr3/3=32πr3/3。
所以空间利用率为(32πr3/3)/(512 r3/3√3)=π√3/16=34.01%
二、密度计算
密度的计算式为
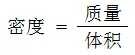
晶体的密度有两种计算形式,一种是知道晶胞边长和晶胞结构进行的计算,一种是知道原子或离子半径和晶胞结构进行的计算。
1、知道晶胞边长和晶胞结构进行的计算
若晶胞为正方体,边长为a pm,含有b个分子,分子的相对分子质量为M,则密度的计算过程为(别记结论,学会计算过程)
晶胞的体积为:(a×10-12m)3= a3×10-36m3
晶胞中分子的总质量为:m=nM=(b/NA)M= bM/6.02×1023g
ρ=M/V=(bM/6.02×1023g) /( a3×10-36m3)=(bM×1013)/(6.02×a3)g/m3
(1)CO2分子晶体的密度计算:
已知CO2分子晶体的结构如下图(面心立方),晶胞边长为572pm(计算数据)。
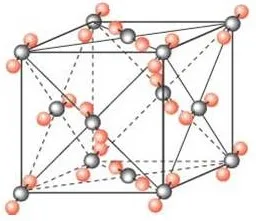
①晶胞中的分子数目计算:8×1/8+6×1/2=4
一个晶胞中有4个CO2。
②晶体密度计算:
m=nM=[4/(6.02×1023/mol)]×44g/mol=2.9236×10-22g
V=(572×10-12)3m3=1.8715×10-28m3
ρ=m/V=2.9236×10-22g /1.8715×10-28m3=1.562×106g/m3=1.562g/ cm3。
(2)Po(钋),相对原子质量为209,晶胞边长为336pm。

①晶胞中原子数目计算:8×1/8=1。
②密度计算:
m=nM=[1/(6.02×1023/mol)]×209g/mol=3.472×10-22g
V=(336×10-12)3m3=3.7933×10-29m3
ρ=m/V=3.472×10-22g /3.7933×10-29m3=9.153 ×106g/m3=9.153g/cm3
2、知道原子或离子半径和晶胞结构进行的计算
先用原子或离子的半径计算出晶胞的边长,然后再进行密度计算。
(1)Na的体心立方
Na的原子半径r=186pm。
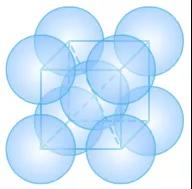
①晶胞中的原子数目计算:8×1/8+1=2。
②密度计算:
先计算晶胞的边长a:根据体对角线=√3a=4r,
边长a=4r/√3=4×186pm/√3=429.56pm。
m=nM=[2/(6.02×1023/mol)]×23g/mol=7.6412×10-23g
V=(429.56×10-12)3m3=7.9263×10-29m3
ρ=m/V=7.6412×10-23g /7.9263×10-29m3=9.64 ×105g/m3=0.964g/cm3
(2)Zn的六方堆积:
Zn的范德华半径为139pm。
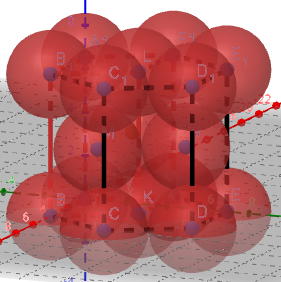
①正六棱柱中原子数目计算:12×1/6+2×1/2+3=6
②密度计算:六方最密堆积不是正方体晶胞,不能用正方体的公式计算。
用上面的正六棱柱计算,正六棱柱的边长为278pm。
若边长为r,体积为24√2 r3。(计算式见空间利用率计算的(3))
V=24√2 r3=24√2×(139×10-12m)3=9.1153×10-29m3
m=nM=[6/(6.02×1023/mol)]×65.38g/mol=6.5163×10-22g
ρ=m/V=6.5163×10-22g /9.1153×10-29m3=7.15 ×106g/m3=7.15g/cm3
(3)金刚石原子晶体的结构


①晶胞中的原子数目计算:8×1/8+6×1/2+4=8
②密度计算:以金刚石结构为例,C的共价半径为77pm。
大立方体的边长为8r/√3,即355.65 pm。(计算式见空间利用率计算的(4))
m=nM=[8/(6.02×1023/mol)]×12g/mol=1.5947×10-22g
V=(355.65×10-12)3m3=4.4985×10-29m3
ρ=m/V=1.5947×10-22g /4.4985×10-29m3=3.545 ×106g/m3=3.545g/cm3
(4)离子晶体的密度计算:
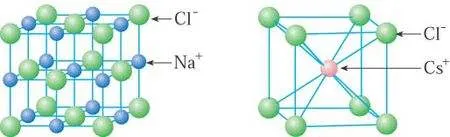
①NaCl:Na+的离子半径为95pm,Cl-的离子半径为181pm
晶胞边长的计算:2r(Na+)+2r(Cl-)=552pm。
其中含Na+4个,Cl-4个。
m=nM=[4/(6.02×1023/mol)]×23g/mol+[4/(6.02×1023/mol)]×35.45g/mol=3.8837×10-22g
V=(552×10-12)3m3=1.682×10-28m3
ρ=m/V=3.8837×10-22g /1.682×10-28m3=2.309×106g/m3=2.309g/cm3
②CsCl:Cs+的离子半径为169pm,Cl-的离子半径为181pm。
晶胞边长的计算:[2r(Cs+)+2r(Cl-)]/√3=404.15pm。

其中含Cs+1个,Cl-1个。
m=nM=[1/(6.02×1023/mol)]×132.9g/mol+[1/(6.02×1023/mol)]×35.45g/mol=2.7965×10-22g
V=(404.15×10-12)3m3=6.6013×10-29m3
ρ=m/V=2.7965×10-22g /6.6013×10-29m3=4.236×106g/m3=4.236g/cm3
③CaF2:Ca2+的离子半径为99pm,F-的离子半径为136pm。
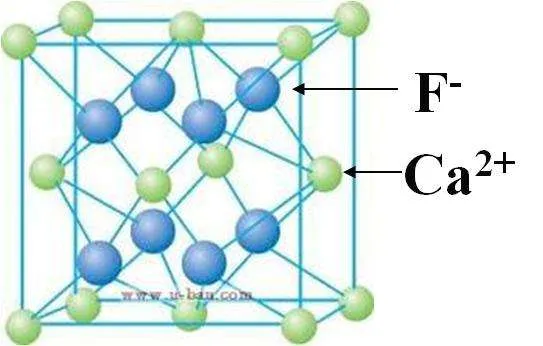
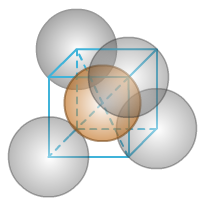
右侧为晶胞的八分之一
晶胞边长计算为2{[2r(Ca2+)+2r(F-)]/√3}=542.71pm。
其中含Ca2+4个,F-8个,则密度为
M=nm=[4/(6.02×1023/mol)]×40g/mol+[8/(6.02×1023/mol)]×19g/mol=5.1827×10-22g
V=(542.71×10-12)3m3=1.5985×10-28m3
ρ=m/V=5.1827×10-22g /1.5985×10-28m3=3.242×106g/m3=3.242g/cm3
【练习】
1、求金属晶体的面心立方的空间利用率,写出详细解题过程。
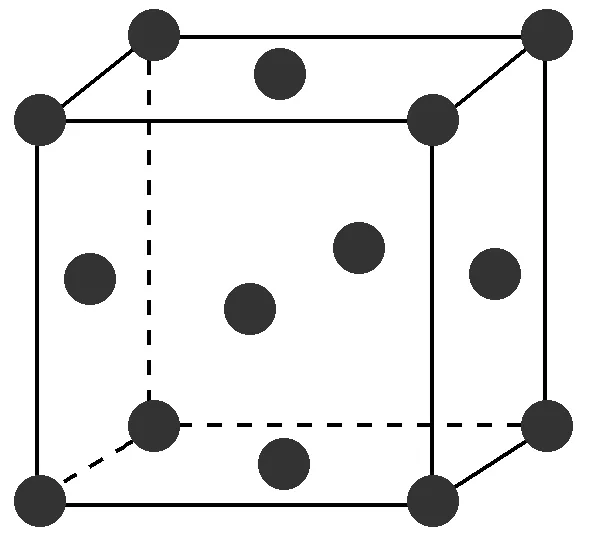
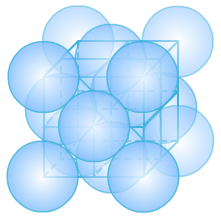
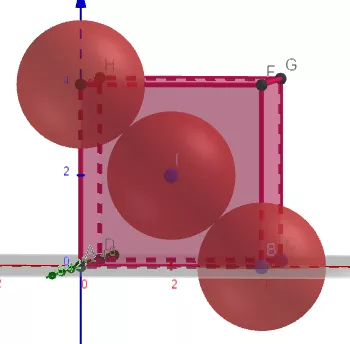
2、Ag的面心立方堆积,已知,Ag的原子半径为144pm。求Ag的密度,写出详细解题过程。
【练习答案】
1、①晶胞中的原子数目计算:8×1/8+6×1/2=4。
②空间利用率计算:设球半径为r,则正方体的面对角线为4r。
又因为正方体的面对角线是边长的√2倍,则正方体的边长为2√2r。
原子的总体积为4×4πr3/3=16πr3/3,正方体的体积为16√2r3。
空间利用率为(16πr3/3)/(16√2 r3)=π/3√2= 74.05%
2、①晶胞中的原子数目计算:8×1/8+6×1/2=4。
②密度计算:
先计算晶胞的边长a:根据面对角线=√2a=4r,
边长a=4r/√2=4×144pm/√2=407.29pm。
m=nM=[4/(6.02×1023/mol)]×108g/mol=7.1761×10-22g
V=(407.29×10-12)3m3=6.7563×10-29m3
ρ=m/V=7.1761×10-22g /6.7563×10-29m3=1.062 ×107g/m3=10.62g/cm3

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。陷阱1、物质的状态。 命题中常涉及物质的体积,需考虑是否为气体。 例如,标准状况下H...
一、数列的表达式问题 例:(2019高考全国卷Ⅲ)直链的多磷酸盐是一种复杂磷酸盐,如:...
晶体中某原子或离子的配位数:是指离中心原子或离子最近的原子或离子的个数。 1 、观...
在“难点四:突破电子式书写的困惑”中,已经详细介绍了利用路易斯理论写电子式的方法...
1 、熟悉常见的有机合成路线 RCH=CH 2 → RCH 2 CH 2 X → RCH 2 CH 2 OH → RCH 2 CH...
现在很多简单的实验考查,常常不再考查明显的实验错误,而是考查实验的细节问题。 一...