
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!

三、晶体的晶胞粒子数计算、空间利用率的计算、密度计算。(晶体计算其实很简单,用到一点数学中的立体几何知识,加上简单的长度计算和立方体、球体的体积计算)
计算通式:(正方体晶胞)
若正方体的边长为a pm,含有b个分子,分子的相对分子质量为M,则密度的计算方法为
ρ=M(g/mol)×{[b/(a×10-12m)3]/6.02×1023(/mol)}
=(Mb×1013)/(6.02×a3)g/m3
1、分子晶体的结构
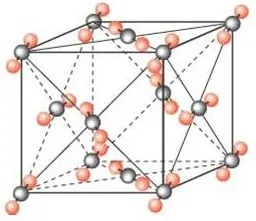
由于CO2分子大小未知,CO2分子之间也不是最密堆积,所以不要求计算空间利用率,只要求计算晶胞中有多少个CO2分子。
(1)晶胞中的分子数目计算:8×1/8+6×1/2=4
一个晶胞中有4个CO2。
(2)晶体密度计算:晶胞边长为572.265pm(计算数据)。
ρ=(Mb×1013)/(6.02×a3)g/m3
=(44×4×1013)/(6.02×572.2653) g/m3
=1560000g/m3=1.56g/ cm3
实际干冰的密度为1.56g/ cm3。
2、原子晶体的结构
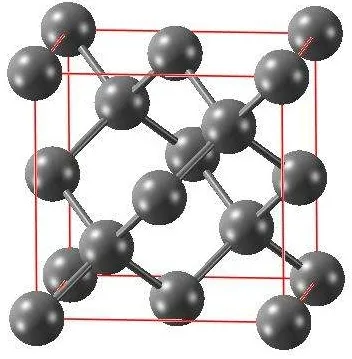
(1)晶胞中的原子数目计算:8×1/8+6×1/2+4=8
一个晶胞中有8个C。
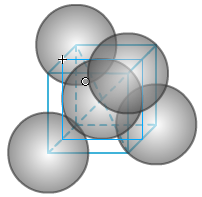
(2)空间利用率计算:根据两个C之间紧密相邻,设C的原子半径为1,则C-C为2。
大立方体切8个小立方体,其中一个如右图。中间球位于小立方体的中心。小立方体的体对角线为2,小立方体的边长为4/√3。
求得大立方体的边长为8/√3,体积为512/3√3。
大立方体内的碳原子数为:8×1/8+6×1/2+4=8,总体积为8×π×4/3。
所以空间利用率为(8×4π/3)/(512/3√3)=34.01%
(3)密度计算:以金刚石结构为例,C的共价半径为77pm。
ρ=12(g/mol)×{[8/(512/3√3)] ×(77×10-12m)3}/[6.02×1023(/mol)]
=3.545×106g/ m3=3.545 g/ cm3
实际金刚石的密度为3.52 g/ cm3。
4、金属晶体的结构
(1)简单立方

①晶胞中原子数目计算:8×1/8=1。
②空间利用率计算:设球的半径为1,则正方体的边长为2,正方体的体积为8。
原子的总体积为4π/3。
空间利用率为(4π/3)/8=52.36%
③密度计算:若为Po(钋),原子半径为153pm,晶胞边长为336pm(资料数据)。则密度为
ρ=(Mb×1013)/(6.02×a3)g/m3
=(209×1×1013)/(6.02×3363)g/m3
=9.15 ×106g/m3=9.15g/cm3
实际Po的密度9.32g/cm3。
(2)体心立方
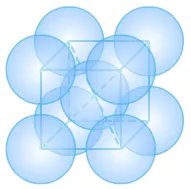
①晶胞中的原子数目计算:8×1/8+1=2。
②空间利用率计算:在体心立方中,设为球半径为1,则正方体的体对角线为4,正方体的边长为4/√3。
正方体的体积为64/3√3。
原子的总体积为2×4π/3。
空间利用率为(2×4π/3)/(64/3√3)= 68.02%
③密度计算:若为Na,原子半径为186pm。
计算得晶胞边长为429.56pm。则密度为
ρ=(Mb×1013)/(6.02×a3)g/m3
=(23×2×1013)/(6.02×429.563)g/m3
=9.64 ×105g/m3=0.964g/cm3
实际Na的密度0.968g/cm3。
(3)面心立方
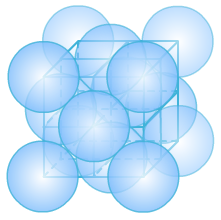
①晶胞中的原子数目计算:8×1/8+6×1/2=4。
②空间利用率计算:设球半径为1,则正方体的面对角线为4,正方体的边长为2√2。
正方体的体积为16√2。
原子的总体积为4×4π/3=16π/3。
空间利用率为(16π/3)/(16√2)= 74.05%
③密度计算:若为Ag,原子半径为144pm。
计算得晶胞边长为407.29pm。则密度为
ρ=(Mb×1013)/(6.02×a3)g/m3
=(108×4×1013)/(6.02×407.293)g/m3
=10.62 ×106g/m3=10.62g/cm3
实际Ag的密度10.5g/cm3。
(4)六方堆积
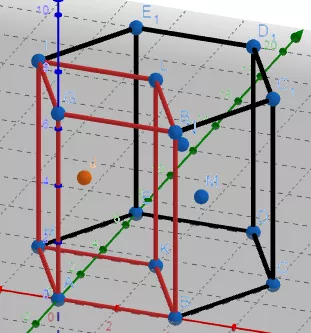
红色代表一个晶胞
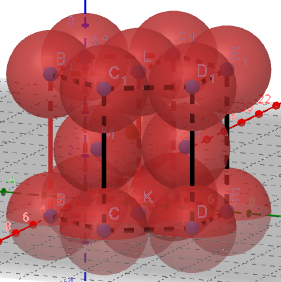
①正六棱柱中原子数目计算:12×1/6+2×1/2+3=6
(晶胞为正六棱柱的1/3,则原子数目为2)
②空间利用率计算:设球的半径为1,则面上正六边形的边长为2,面积为6×√3=6√3。
正六棱柱的高为2×(2√6/3)=4√6/3,正六棱柱的体积为(6√3)×(4√6/3)=24√2。
(晶胞体积为正六棱柱的1/3,为8√2)
原子的总体积为2×4π/3=8π。
空间利用率为2π/(8√2)= 74.05%
③密度计算:六方最密堆积不是正方体晶胞,不能用正方体的公式计算。
若为Zn,范德华半径为139pm,用上面的正六棱柱计算,则密度为
ρ={65.38g/mol×2/[8√2× (139×10-12m)3]}/(6.02×1023/mol)
=7.15×106g/ m3=7.15g/cm3
实际Zn的密度7.14g/cm3。
4、离子晶体的密度计算:
①NaCl:Na+的离子半径为95pm,Cl-的离子半径为181pm
计算得晶胞边长为552pm。
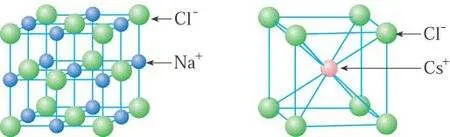
其中含Na+4个,Cl-4个,则密度为
ρ=(Mb×1013)/(6.02×a3)g/m3
=[(23×4+35.45×4)×1013]/(6.02×5523)g/m3
=2.312 ×106g/m3=2.312g/cm3
实际NaCl的密度2.165g/cm3。
②CsCl:Cs+的离子半径为169pm,Cl-的离子半径为181pm
计算得晶胞边长为404pm。
其中含Cs+1个,Cl-1个,则密度为
ρ=(Mb×1013)/(6.02×a3)g/m3
=[(132.9+35.45)×1013]/(6.02×4043)g/m3
=4.24 ×106g/m3=4.24g/cm3
实际CsCl的密度3.98g/cm3。
③CaF2:Ca2+的离子半径为99pm,F-的离子半径为136pm
计算得晶胞边长为542.7pm。
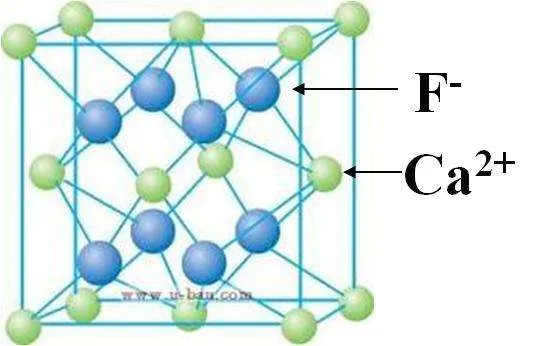
其中含Ca2+4个,F-8个,则密度为
ρ=(Mb×1013)/(6.02×a3)g/m3
=[(40×4+19×8)×1013]/(6.02×542.73)g/m3
=3.24 ×106g/m3=3.24g/cm3
实际CaF2的密度3.18g/cm3。
【练习】
1、下图为CO2晶胞,一个晶胞中包含个CO2分子。

2、金刚石的晶胞如下图所示,一个晶胞中包含个碳原子。

3、计算下面的正六棱柱中有多少个球。。

4、计算简单立方堆积的空间利用率。写出计算式:。

5、若某金属的相对原子质量为X,原子半径为y pm,晶体中原子的堆积方式为简单立方,求此金属的密度。写出计算过程。
【练习答案】
1、4。
2、8。
3、6。
4、设球的半径为1,则正方体的边长为2,正方体的体积为8。
原子的总体积为4π/3。
空间利用率为(4π/3)/8=π/6=52.36%
5、ρ=(Mb×1013)/(6.02×a3) g/m3
=(X×1×1013)/[6.02×(2y)3]g/m3
=4×1015X/301y3(g/m3)

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
三、键的极性、分子的极性、范德华力、氢键 1、键的极性 共价...
三、烃的衍生物的化学性质 除醇之外, 其它的简单衍生物,常...
除了醇之外,其它各种简单有机物的特殊反应都很少,掌握起来...
一、有机物的燃烧反应 1 、烃的燃烧反应通式: 。 2 、烷的燃烧...
一、硫酸盐类: 1、胆矾、蓝矾: 。 2、重晶石: 。 3、绿矾:...
一、金属的化学反应 1、钠 (1)Na 2 O 2 与CO 2 反应 。 (2)Na 2 O 2 与...