
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
2013年宁夏高考考试说明对选考内容《物质结构与性质》部分中要求了解金属晶体及堆积模型,金属晶体是四种常见晶体类型之一,知识内容多,联系面广,是晶体结构考查较为广泛的要点之一。针对这一要求与学生复习中的难度规将内容从如下几个方面进行分析。
1金属晶体与金属键
金属晶体中原子间的结合能较大,显然是一种较强的化学键金属晶体中原子之间的化学作用力叫做金属键,是化学键的一种类型。金属原子的电离能低,容易失去电子而形成阳离子和自由电子,阳离子整体共同整体吸引自由电子而结合在一起。这种金属离子与自由电子之间的较强作用就叫做金属键。金属键可看成是由许多原子共用许多电子的一种特殊形式的共价键。这种键既没有方向性也没有饱和性。金属键的特征是成键电子可以在金属中自由流动,使得金属呈现出特有的属性在金属单质的晶体中,原子之间以金属键相互结合。金属键是一种遍布整个晶体的离域化学键。对金属键的本质有不同的解释,在中学化学选修3《物质结构与性质》一书中这样描述“金属键本质的最简单理论是电子气理论,该理论把金属键描述为金属原子脱落下来的价电子形成遍布整块晶体的`电子气'被所有原子所共有从而把所有的金属原子维系在一起”。就是利用电子气理论十分形象地解释了金属具有很多通性,如金属都具有导电性、导热性、良好的延展性等等。而由于形成金属键的强弱不同金属单质的熔点、硬度等性质的差别也是很大的。一般情况下金属键的强弱要从离子半径和离子所带的电荷两个方面结合起来分析,即离子半径越小,离子所带电荷越大则金属键越强金属的熔沸点越高和硬度越大。由于金属晶体的这种特殊性,使得它的结构与其它晶体不同。这要从它的原子堆积形式说起。
2金属晶体的堆积模型
由于金属键没有方向性海个金属原子(或离子)的电子云分布基本上是球形对称的。因此可以把同一种金属原子看成是半径相等的圆球,而且在一个金属原子周围可以依几何原理排列尽可能多的原子,以使体系的能量尽可能低。这就是说金属的晶体结构服从球的密堆积原理。在晶体中原子或离子等称为微粒,微粒之间的作用力使微粒间尽可能的相互接近,使它们占有最小的空间这种方式叫紧密堆积。而在晶体中与每个微粒紧密相邻的微粒个数又叫配位数。微粒的堆积方式分别在二维空间和三维空间进行密堆积。
2.1二维空间(二维平面上)的堆积模型
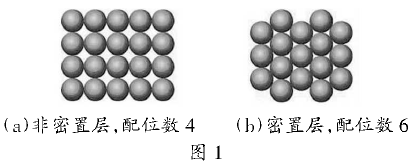
金属晶体中的原子可看成直径相等的小球。将等径圆球在一平面上排列,有两种排布方式,配位数分别为4和6,按图1中(a)图方式排列,剩余的空隙较大称为非密置层,配位数为4;按图1中(b)图方式排列圆球周围剩余空隙最小,称为密置层,配位数为6。
2.2三维空间的堆积模型
金属晶体可看成金属原子非密置层和密置层一层一层在三维空间堆积而成,有如下几种堆积模式。
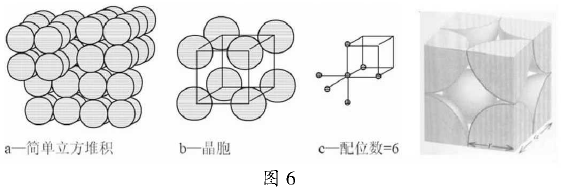
1)简单立方体堆积相邻非密置层原子的原子核在同一直线的堆积方式加图2
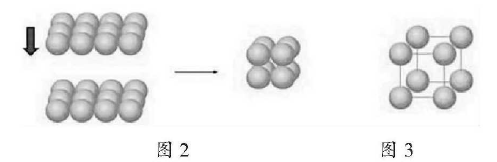
为清晰起见胧们使金属原子不相接触,以便更好地考察这种堆积的晶胞加图3。这种堆积方式形成的晶胞是一个立方体,每个晶胞含1个原子被称为简单立方堆积。这种堆积方式的空间利用率太低,只有金属钋(Po)采取这种堆积方式。
2)体心立方堆积
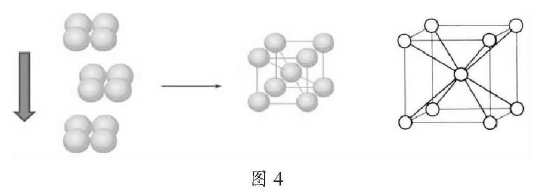
如果是非密置层上层金属原子填入下层的金属原子形成的凹穴中,每层均照此堆积。如图这种堆积方式的空间利用率显然比简单立方堆积的高多了。许多金属是这种堆积方式,如(Na、K、Fe)简称为钾型。配位数均为8。
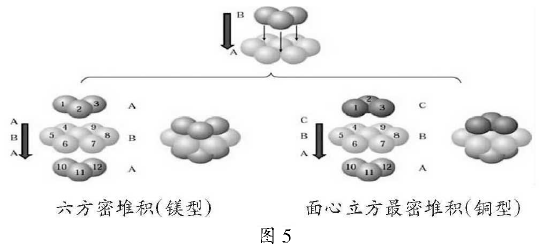
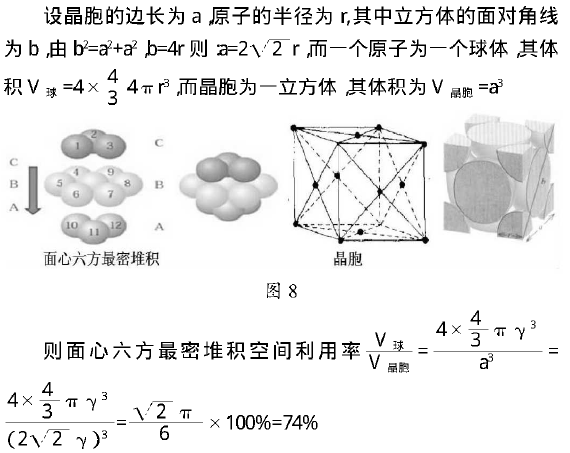
3)六方最密堆积和面心六方最密堆积
如果密置层的原子按钾型堆积方式堆积,会得到两种基本堆积方式为六方最密堆积和面心六方最密堆积简称镁型和铜型。镁型如下图左侧,按ABABABAB··的方式堆积;铜型如图右侧技ABCABCABC··的方式堆积。这两种堆积方式都是金属晶体的最密堆积,配位数均为12,但所得的晶胞的形式不同。
3金属晶体的堆积模型及空间利用率的计算方法
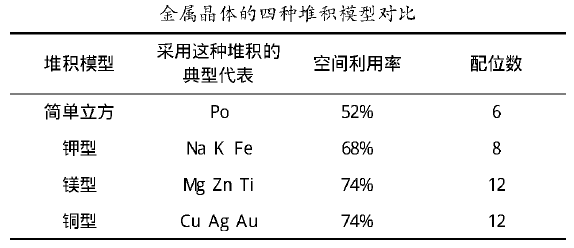
金属晶体的堆积模型目前分为四类其典型的代表物、配位数、空间利用率如下表所示。
而空间利用率是什么?如何得出各数据?在此我们借助于数学思维解决这一难题。
空间利用率是指晶体的空间被微粒占满的体积百分数,用它来表示紧密堆积的程度又叫空间占有率。根据堆积模型不同进行计算。
3.1简单立方体堆积
这种堆积方式形成的晶胞是一个立方体,每个晶胞含1个原子被称为简单立方堆积。配位数为6,堆积方式的空间利用率则为一个原子的体积与晶胞的体积之比。
简单立方堆积的原子,其晶胞为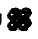 ,按均摊法则可看做如上右图所示。
,按均摊法则可看做如上右图所示。
此时就将化学问题转化为数学图形,设晶胞的边长为a,原子的半径为r,一个原子为一个球体,其体积V球=4/3πr3。而晶胞为一立方体,其体积为V晶胞=a3,且r=a/2

3.2体心立方堆积(钾型)
这种堆积方式形成的晶胞是一个立方体,每个晶胞含2个原子被称为体心立方堆积。堆积方式的空间利用率显然比简单立方堆积的高多了,许多金属是这种堆积方式加(Na、K、Fe)简称为钾型,配位数均为8。按均摊法则可看做如下右图所示

3.3面心六方最密堆积(铜型)
这种堆积方式形成的晶胞是一个立方体,每个晶胞含4个原子被称为面心六方最密堆积。堆积方式的空间利用率比体心立方堆积的高,如(CuAgAu)等为这种堆积方式简称为铜型,配位数均为12。按均摊法则可看做如下右图所示。
【链接高考】金属钨晶体中的晶胞的结构模型如图所示,它是一种体心立方结构。实验测得金属钨的密度为ρg/cm3,钨的相对原子质量是M。假设金属钨原子为等直径刚性球,试完成下列问题:
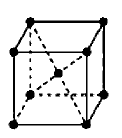
1)每一个晶胞中平均含有 个钨原子。
2)计算晶胞的边长a为
3)计算钨的原子半径r为 〔提示:只有体对角线上的各个球才是彼此接触的)。
4)金属钨原子形成的体心立方结构的空间利用率为

以上对金属晶体的堆积模型及空间利用率进行了分析,借助数学知识对化学问题从定量的角度做出理解,降低了知识的难度,以便更好的去应对高考对晶体知识的考查。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
在晶体结构中,阳离子周围的阴离子总配位数,等于阴离子周围的阳离子总配位数。我们称...
一、投影是什么? 从数学的角度来说,一般地,用光线照射物体,在某个平面上得到的影...
金刚石晶胞中的原子排列方式图进行计算。 ①空间占用率的计算: 图中的原子数目计算:...
微粒间距离的计算常常涉及晶体密度、 N A 、 M 、晶体体积等数据,解答这类题目时,一...
晶胞投影问题是 《 物质结构与性质 》 这一 部分的重点和难点 , 在高考中考查起点高...