
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、目的及要求
1、制备复盐(NH4)2SO4·FeSO4·6H2O,了解复盐的特性;
2、掌握无机制备的基本操作;
3、初步了解纯度的检验方法和步骤。
二、预习提问
1、 定量分析中常用什么来配置亚铁离子的标准溶液?为什么?
答:(NH4)2SO4·FeSO4·6H2O。因为一般亚铁盐在空气中易被氧化,但形成复盐后就比较稳定。
2、 制备复盐(NH4)2SO4·FeSO4·6H2O的原理是什么?
答:等物质的量的FeSO4与(NH4)2SO4作用,生成硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O。
3、复盐有什么特性?
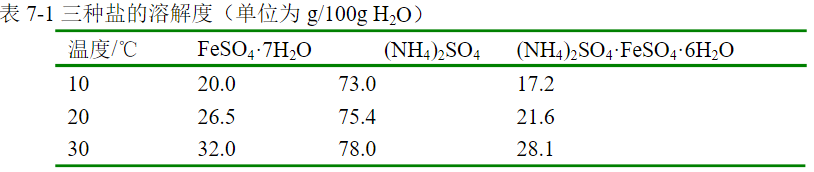
答:溶解度较小。比如 (NH4)2SO4·FeSO4·6H2O在水中的溶解度比组成的每一组[(NH4)2SO4或FeSO4]的溶解度都要小。
4、什么是差减称量法?
答案:①按直接称量法称出物重W1②从右盘减去要称得某一数量试样(最好是略少)的砝码,然后从左盘取出称量瓶经多次倾倒,直到倾出试样与要求相符,设其质量为W2 ,则ΔW=W1 — W2
三、实验原理
铁屑溶于稀H2SO4生成FeSO4,而等物质的量FeSO4与(NH4)2SO4作用,能生成溶解度较小硫酸亚铁铵,商品为摩尔盐,常被用作还原剂,在定量分析中用作滴定K2Cr2O7、KMnO4的浓度。
FeSO4 + (NH4)2SO4 + 6H2O = (NH4)2SO4·FeSO4·6H2O
一般亚铁盐容易被氧化,但形成复盐后就比较稳定,因此在定量分析中常用来配制亚铁离子标准液。
和其他复盐一样,在水中的溶解度比组成的每一组[(NH4)2SO4或FeSO4]的溶解度都要小。
四、实验仪器与药品
1、仪器:
蒸发皿、锥形瓶、吸滤瓶、布氏漏斗、酸式滴定管、容量瓶、量筒、普通漏斗
2、药品:
H2SO4 6 mol·L-1、 FeSO4固体、二苯胺磺酸钠、(NH4)2SO4固体、H3PO4 85%、K2Cr2O7溶液 、
五、操作步骤
1、(NH4)2SO4·FeSO4·6H2O的制备:
称取2.5g FeSO4·7H2O溶解于20mL 蒸馏水中,再称取2g (NH4)2SO4倒入FeSO4溶液中,水浴蒸发,浓缩至表面出现晶膜为止,冷却,得到(NH4)2SO4·FeSO4·6H2O晶体。抽滤,并用酒精洗去晶体表面的水分,抽干,取出,吸干,观察晶体的颜色与状态,称量,计算产率。
2、(NH)2SO4·FeSO4·6H2O含量的测定:
![]()
1)配制K2Cr2O7标准溶液
10mL 2.5 mol·L-1 K2Cr2O7溶液转移入250mL 容量瓶中,稀释定容。
2)测定含量
用差减法称取0.8-1.2g(准确至0.1mg)所制得的(NH4)2SO4·FeSO4·6H2O两份,分别放入2个250mL 锥形瓶中,各加100mL H2O及10mL 6mol·L-1 H2SO4,滴加6—8d二苯胺磺酸钠指示剂,用K2Cr2O7的标准溶液滴定至溶液出现深绿色时,加5mL 85%H3PO4,继续滴加至溶液呈现蓝色或蓝紫色即为终点。
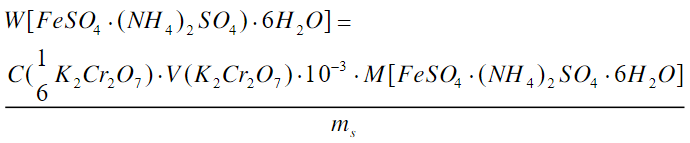
六、实验注意事项
1、浓缩(NH4)2SO4·FeSO4·6H2O时不要蒸干;
2、要采用抽滤去除尽可能多的水分。
3、 滴定操作要定量进行。
七、思考题
1、本实验计算(NH4)2SO4·FeSO4·6H2O的产率时,以FeSO4的量为准是否正确?为什么?
答:在误差范围内是可以的,因为该复盐的生成是按定量比进行的。
2、浓缩(NH4)2SO4·FeSO4·6H2O时能否浓缩至干,为什么?
答:不可以。防止分解。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一、实验方案的设计与评价的一般原则 一个相对完整的化学实验...
一、无水盐的用途 无水盐在化学合成中有很多应用,比如做反应...
化学实验方案的设计是指在实施化学实验之前,根据化学实验的...
探 究 实 验 1、含有酚酞的氢氧化钠的溶液中,滴加新制氯水,...
化学实验方案设计的基本要求; (2)一个相对完整的化学实验方案...
玻璃仪器上所标的刻度存在区别,有的仪器“0”刻度在仪器下方...