
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
电解质溶液中离子浓度大小比较问题,是高考热点中的热点。此类题主要考查弱电解质的电离平衡、盐类水解平衡等离子平衡、电荷守恒、物料守恒、质子守恒、pH及离子浓度计算等,目前常出现多元酸与强碱反应体系中微粒分布分数图或微粒浓度分布图的试题,其解题思维关键:要认真“读图、识图、用图”,要关注“反应、平衡、定量”,做到曲线段段清,微粒个个明。
例1.(2015浙江联考)常温下,H3PO4与NaOH溶液反应的体系中,含磷各微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与 pH 的关系如图所示[已知Ca3(PO4)2难溶于水]。下列有关说法不正确的是(
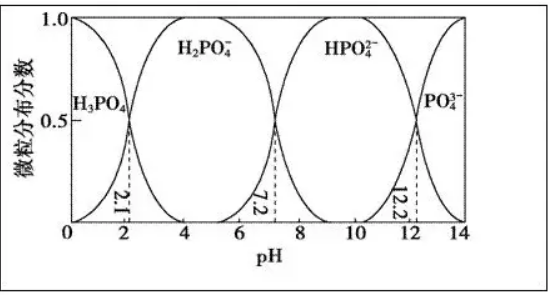
A.H3PO4的K3=10-12.2,HPO42-的水解平衡常数为10-6.8
B.Na2HPO4 溶液显碱性,若向溶液中加入足量CaCl2溶液,溶液则显酸性
C.为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右
D.pH=13时,溶液中各微粒浓度大小为:c(Na+)﹥c(HPO42-)﹥c(PO43-)﹥c(OH-)﹥c(H+)
解析:读图知H3PO4与NaOH溶液发生中和反应后形成4个分区,如图所示:
①pH=0~2.1,H3PO4的分布分数由1.0减为0.5,H2PO4-由0增为0.5;
②pH=2.1~7.2,H3PO4由0.5减为0,H2PO4-由0.5先增为1.0后又减为0.5,HPO42-由0增为0.5;
③pH=7.2~12.2,H2PO4-由0.5减为0,HPO42-由0.5增为1.0后又减为0.5,PO43-由0增为0.5;
④pH=12.2~14,HPO42-由0.5减为0,PO43-由0.5增为1.0。
A项涉及两个平衡:HPO42- H++PO43-,HPO42-+H2O
H++PO43-,HPO42-+H2O H2PO4-+OH-,识图并用图:pH=12.2,c(PO43-)=c(HPO42-),K3(H3PO4)=c(H+)·c(PO43-)/c(HPO42-)=10-12.2;pH=7.2,c(H2PO4-)=c(HPO42-),HPO42-水解平衡常数Kh=c(OH-)·c(H2PO4-)/c(HPO42-)=10-6.8,选项A对。选项B涉及离子反应:2HPO42-+3Ca2+==Ca3(PO4)2↓+2H+,显然溶液显酸性;或从电离平衡分析:HPO42-
H2PO4-+OH-,识图并用图:pH=12.2,c(PO43-)=c(HPO42-),K3(H3PO4)=c(H+)·c(PO43-)/c(HPO42-)=10-12.2;pH=7.2,c(H2PO4-)=c(HPO42-),HPO42-水解平衡常数Kh=c(OH-)·c(H2PO4-)/c(HPO42-)=10-6.8,选项A对。选项B涉及离子反应:2HPO42-+3Ca2+==Ca3(PO4)2↓+2H+,显然溶液显酸性;或从电离平衡分析:HPO42- H++PO43-,加入足量的CaCl2 溶液,生成Ca3(PO4)2沉淀,平衡正移,溶液显酸性,选项B对。识图并用图:pH=4~5.5,H2PO4-的分布分数是1.0(最大),选项C对。pH=13,HPO42-的分布分数明显比PO43-小,则c(PO43-)﹥c(HPO42-),选项D错。若该题是单项选择,则先定性分析可快得D为正确答案。
H++PO43-,加入足量的CaCl2 溶液,生成Ca3(PO4)2沉淀,平衡正移,溶液显酸性,选项B对。识图并用图:pH=4~5.5,H2PO4-的分布分数是1.0(最大),选项C对。pH=13,HPO42-的分布分数明显比PO43-小,则c(PO43-)﹥c(HPO42-),选项D错。若该题是单项选择,则先定性分析可快得D为正确答案。
例2.已知H2R为二元弱酸:H2R HR-+H+
HR-+H+  R2-+H+
R2-+H+
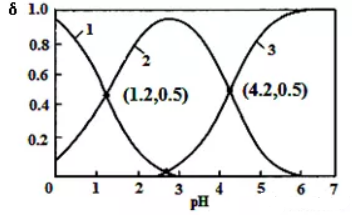
A.pH=1.2溶液中:c(K+)+c(H+)=c(OH-)+c(H2R)
B.pH=2.7溶液中:c2(HR-)/[c(H2R)×c(R2-)]=1000
C.将相同物质的量KHR和K2R固体完全溶于水可配得pH为4.2的混合液
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离程度一直增大
解析:读图知H2R与KOH反应后存在H2R、HR-、R2-三条曲线变化,pH=1.2,第一个交汇点c(H2R)=c(HR-),此时溶液中c(R2-)几乎为0,电荷守恒知:c(K+)+c(H+)=c(OH-)
感悟:例1、例2属于多元酸与强碱反应体系中微粒分布分数图的试题,综合性强,难度较大。虽然考查主题是离子浓度大小比较,但一道选择题就会达到相关知识的全面考查,如强弱电解质、电离平衡、水的电离、pH、离子反应、盐类水解等基本概念都是考查的重点内容。解题思维关键:要结合各点pH将曲线图中的各线与交汇点分析到位,明确各种微粒的定量关系,离子浓度大小比较以及与电离平衡、水解平衡等知识就会一目了然。
例3.(2016江苏高考)H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是(
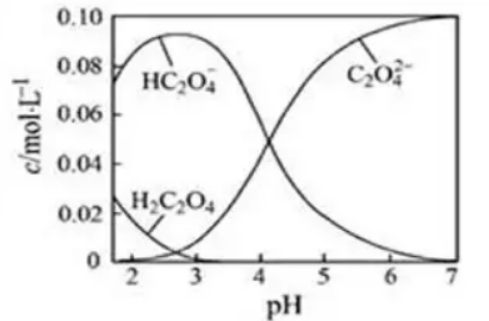
A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)﹥c(HC2O4-)
B.c(Na+)=0.100mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
C.c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol·L-1+c(HC2O4-)
D.pH=7的溶液中:c(Na+)﹥2c(C2O42-)
解析:读图知H2C2O4与NaOH反应有H2C2O4、HC2O4-、C2O42-三条曲线变化。识图并用图:pH=2.5,可知c(H2C2O4)+c(C2O42-)﹤c(HC2O4-),选项A错;c(Na+)=0.100mol·L-1,由物料守恒知:c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),电荷守恒知:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),两式相减得c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-),选项B对;当c(HC2O4-)=c(C2O42-)时,此时溶液中c(H2C2O4)几乎为0,溶液为等物质的量的NaHC2O4与Na2C2O4混合,且溶液显酸性,由电荷守恒式与c(HC2O4-)+c(C2O42-)=0.100mol·L-1,两式相减得c(Na+)+c(H+)=c(OH-)+0.100mol·L-1+c(HC2O4-),因c(H+)﹥c(OH-),故c(Na+)﹤0.100mol·L-1+c(HC2O4-),选项C错;pH=7时是NA2C2O4溶液,C2O42-水解,故c(Na+)﹥2c(C2O42-),选项D对。正确答案为BD。
例4.25℃时,已知H2CO3的电离常数为Ka1=4.3×10-7,Ka2=5.6×10-11。现取0.10mol Na2CO3 与盐酸混合所得的一组体积为1 L溶液,溶液中部分微粒与pH 的关系如图所示。在25℃时,下列有关溶液中离子浓度关系叙述正确的是(
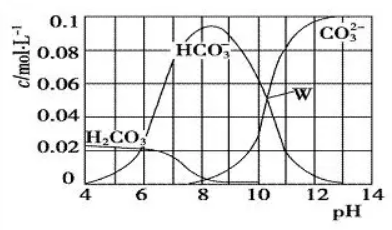
A.W 点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)
B.pH=4 的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1mol·L-1
C.pH=8 的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-)
D.pH=11 的溶液中:CO32-+H2O  HCO3-+OH- K ≈2.5×l0-4
HCO3-+OH- K ≈2.5×l0-4
解析:读图知Na2CO3与盐酸反应:H++CO32-==HCO3-,H++HCO3-==H2CO3,H2CO3==CO2↑+H2O,有H2CO3、HCO3-、CO32-三条曲线变化。识图并用图:W 点为等物质的量NaHCO3、Na2CO3、NaCl混合溶液,由电荷守恒知c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-),选项A缺少了c(Cl-)故错。pH=4,以H2CO3溶液为主,由于CO2可逸出溶液,故由物料守恒知c(H2CO3)+c(HCO3-)+c(CO32-)﹤0.1mol·L-1,选项B错。识图并用图:pH=8,溶液中NaHCO3的浓度远大于Na2CO3的浓度,说明溶液以HCO3-为主,由物料守恒知:c(H2CO3)+c(HCO3-)+c(CO32-)=c(Cl-)=1/2c(Na+),结合电荷守恒可推得c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-),选项C错。识图并用图:pH=11,c(CO32-)=0.08mol·L-1,c(HCO3-)=0.02mol·L-1,Kh=c(OH-)·c(HCO3-)/c(CO32-)=10-3×0.02/0.08=2.5×l0-4,正确答案为D。
感悟:例3、例4属于多元酸与强碱反应体系中微粒浓度分布图的综合性试题,对思维能力要求较高。解题思维关键:离不开反应原理与平衡思想,离不开电荷守恒、物料守恒、质子守恒等守恒关系,离不开挖掘隐含在图像中各种微粒的定性与定量关系。
巩固训练:
1.H2CO3和H2C2O4都是二元弱酸,不同pH环境下它们不同形态的粒子的组成百分率如图所示。下列说法正确的是( )
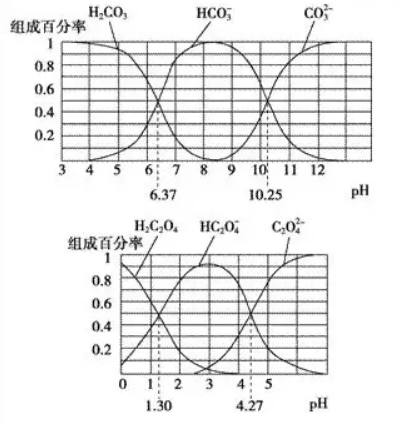
A.在pH为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
B.反应HCO3-+H2O H2CO3+OH-的平衡常数为10-10.25
H2CO3+OH-的平衡常数为10-10.25
C.在0.1 mol·L-1NaHC2O4溶液中c(HC2O4-)+c(C2O42-)+c(H2C2O4)=0.1mol·L-1
D.往Na2CO3溶液中加入少量草酸溶液,发生反应:CO32-+H2C2O4== HCO3-+HC2O4-
2.常温下,在10mL 0.1mol·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法不正确的是(
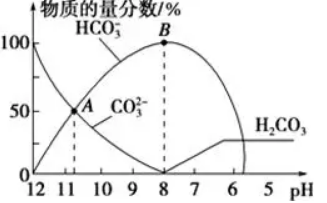
A.在A点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
B.在B点所示的溶液中,浓度最大的离子是Na+
C.当溶液的pH为7时,溶液的总体积大于20mL
D.25℃时,CO32-水解常数Kh=2×10-4mol·L-1,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=10
3.常温下0.10 mol·L-1亚硫酸溶液中H2SO3、HSO3-、SO32-三者所占物质的量分数(α)随pH变化的关系如图所示。下列表述正确的是( )
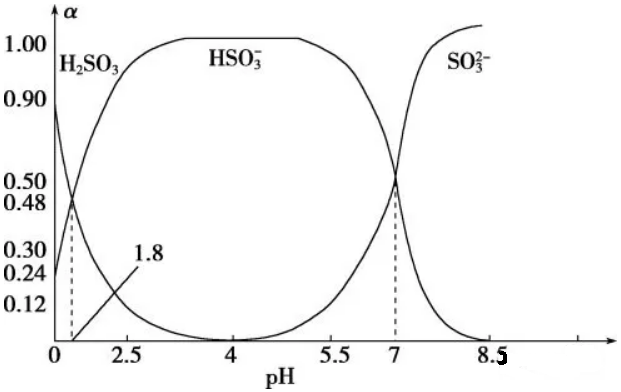
A.H2SO3 2H++SO32- K=10-5.2
2H++SO32- K=10-5.2
B.在0.10 mol·L-1 H2SO3溶液中,存在:c2(H+)=c(H+)·c(HSO3-)+2c(H+)·c(SO32-)+Kw
C.在pH=2.5该溶液中:c(H2SO3)﹥c(HSO3-)﹥c(H+)﹥c(OH-)
D.向pH为8.5的上述体系中通入极少量的Cl2的过程中,溶液中c(HSO3-)和c(SO32-)均减小
4.亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-)没有画出。则下列分析不正确的是( )
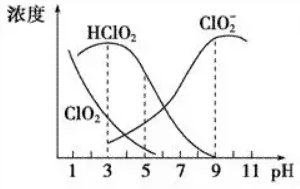
A.亚氯酸钠在碱性条件下较稳定
B.25 ℃时,HClO2的电离平衡常数的数值Ka=10-6
C.使用该漂白剂的最佳pH为3
D.25 ℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合(忽略Cl-),则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-)
参考答案:
1.C

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
双指示剂法是一种利用两种具有不同变色范围的酸碱指示剂,在...
弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常...
...