
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
根据实验事实可知,卤素含氧酸的酸性,按照HClO3→HBrO3 →HIO3的顺序递减,同种元素含氧酸的酸性,如氯的含氧酸的酸性又按照其化合价的升高而递增。这是什么原因?
酸性强弱,一般来说,主要决定于中心原子(离子)R(R代表 卤素原子)的电荷、半径及分子中不与氢原子相连的氧原子数目, 同时还与中心原子(离子)与氯原子产生的配位键数目,R与O及 OH基的电负性(吸引电子能力的大小)等因素有关。如果Rn+的 电荷越多,半径越小,它们对O2-的吸引力和对H+的排斥力就越 大,H+就越容易电离下来,酸性就越强。
现在具体分析一下氯的含氧酸的分子结构情况。
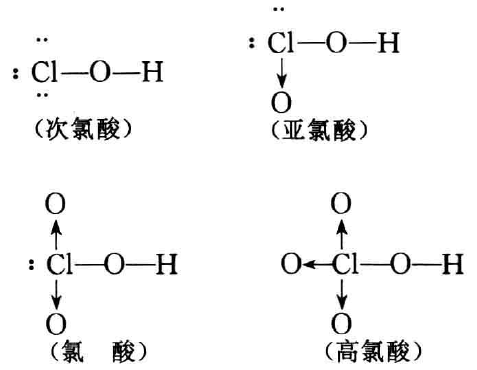
从分子结构中可以看出,从HClO到HClO4,阴离子中的配位 键(Cl→O)数目依次增多(0、1、2、3),Cl原子相对地集中了更多的正电荷而表现为更高的价态,对O2-的吸引力和对H+的排 斥力都增强,使O—H键减弱,因而使酸更易电离,酸性增强。
鲍林从实验中总结了一条经验公式,表达了含氧酸强度与酸分子中非羟基氧原子数目的关系。它把含氧酸用通式表示为
BOn(OH)m,其中n为非羟基氧原子数目。
HClO4→ (HO)ClO3 n = 3 很强酸
HClO3 →(HO)ClO2 n = 2 强酸
HClO2 →(HO)ClO n = 1 中强酸
HClO → HOCl n= 0 弱酸
由此可见,n值越大,酸性越强。这一通式,还可以应用到其他酸的判断。
例如用HClO4与其他酸作如下比较:
HClO→ (HO)ClO3 n = 3 很强酸
H2SO4→ (HO)2SO2 n = 2 强酸
HNO2→(HO) NO n = 1 中强酸
H3PO3→ (HO)3P n=0 弱酸
这个经验公式,对含氧酸强度的判断有普遍的意义。
对卤族元素来讲,从HClO3→HIO3的酸性依次递减。
我们可以从化学式中分析看出,Rn+的电荷都是一样的,但是 半径却依次增大,因而使得R—O的吸引力逐渐减弱,O—H键能 增大,从而使HXO3电离出H+的趋势减小,酸性减弱。
这里需要说明的是,关于判断酸的强度的经验公式很多,但 是迄今为止,不论从哪一个方面来说明酸的强度都是围绕着中心 原子(离子)对O—H基吸引电子来论述的,Rn+的电荷多,电负 性大,半径小,含氧酸根中非羟基氧原子数目或配位键数目多,都 将有利于从O—H基吸引电子而使含氧酸的酸性增大。
对于氧化性来说,其变化方向与酸性增强方向恰好相反,即 HClO>HClO3>HClO4。可能有人会问,既然HClO4的氧化性在 氯的含氧酸中是最弱的,为什么通常又说HClO4是最强的氧化剂 呢?这是由于判断一种物质氧化性的强弱,不仅与其物质的本性 有关,也与其浓度有关。平常我们使用的HClO4的浓度一般为 85%,浓度很大,氧化性很强,如果是纯HClO4,在储藏中有时 都会发生爆炸。而HClO2、HClO3使用的浓度要小得多,相比之 下,氧化性就反而弱了。如果在相同浓度下作比较,HClO4的氧化性还是弱的。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
HF、HCl、HBr、HI的水溶液分别叫氢氟酸、氢氯酸(盐酸)、氢溴酸、...
次氯酸的酸性不强,却有很强的氧化性、漂白性,次氯酸的氧化...
一、HNO 3 为什么不能氧化Cl - ? 硝酸HNO 3 是强氧化剂,Cl - 氯...
氢氟酸是一弱酸(298K时,Ka=3.5×10 -4 )。与其它弱酸相同,浓度越...
卤素是很活泼的非金属元素。单质最典型的化学性质是强氧化性...
F Cl Br I ,卤素,第 Ⅶ A 族, 价电子构型 ns 2 np 5 虽然是同一族...