
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、硼元素成键特点
硼是周期表第三主族唯一的非金属元素,B原子的价电子结构是2s22p1,它能提供成键的电子是2s2p1,还有一个空轨道。这种B原子的价电子少于价轨道数的缺电子情况,但硼与同周期的金属元素锂,铍相比,原子半径小,电离能高,电负性大,以形成共价键分子为特征。
在硼原子以sp2杂化形成的共价分子中,余下的一个空轨道可以作为路易斯酸,接受外来的孤对电子,形成以sp3杂化的四面体构型的配合物。例如三氟化硼与氨气分子形成的配合物;若没有合适的外来电子,可以自相聚合形成缺电子多中心键,例如三中心二电子氢桥键、三中心二电子硼桥键、三中心二电子硼键。
需要注意的是桥键与三中心二电子间的不同。硼桥键中心的硼原子是p轨道与两个杂化轨道的重叠,氢桥键中心的氢原子是s轨道与两个杂化轨道的重叠,而三中心二电子硼键为三个杂化轨道的组合重叠。

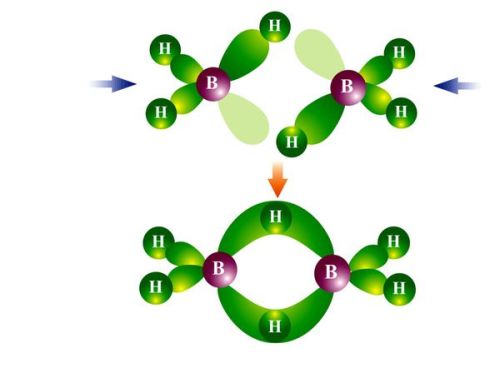
二、乙硼烷结构介绍:
在B2H6分子中,每个B原子都采用sp3杂化,4条杂化轨道中2条与两个H原子形成σ键,这4个σ键在同一平面。另两条杂化轨道和另一个硼原子的两条杂化轨道以及另两个氢的1s轨道重叠并分别共用2个电子,形成了垂直于上述平面的两个三中心二电子键,一个在平面之上,另一个在平面之下(见图)。每个三中心二电子键是由一个氢原子和两个硼原子共用2个电子构成的,又称“硼氢桥键”
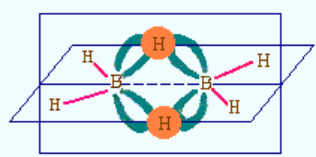
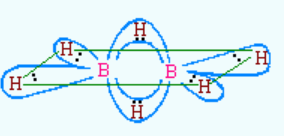
结构解读:
乙硼烷中,硼原子是sp3杂化。因为硼外层三个电子,故只有三个sp3杂化轨道上有一个电子,这三个杂化轨道分别和H成σ键。另一个sp3杂化轨道是空轨道。 两个硼原子靠近生成乙硼烷时,第一个硼原子的空sp3杂化轨道与第二个硼原子上带的一个氢原子接近成键,这样生成一个B-H—B的香蕉状的键,这个键包含三个原子核(B、H、B),但只有两个电子(第一个b原子使用的是空轨道,第二个硼原子使用和H成键的轨道,B、H各一个电子,一共两个电子),因此称为三中心二电子键。 同样,第二个硼原子的空sp3杂化轨道与第一个硼原子上带的一个氢原子接近成键,也会生成一个香蕉状的三中心两电子键。乙硼烷中有两个这样的键。
三、三氟化硼结构解读
由于硼是缺电子结构,三氟化硼形成一个4中心6电子的大π键,6个电子分别由3个氟原子提供,3个氟原子各提供1个全充满的2p轨道,与硼原子的空p轨道肩并肩,形成大π键。B原子以sp2杂化轨道成键,分子为平面正三角形分子。
三氟化硼是不容易形成高聚物的,主要是因为B-F键长较短,pz轨道容易重叠形成大π键。 而其同一族的Al、AlCl3则容易形成二聚物。随着B-X键长从F-Cl-Br-I增大,越来越不容易形成大π键,形成高聚物可能性越来越大,这些高聚物其实是一种多核配合物(主要是因为B是缺电子原子容易接受电子对形成配位键)。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
冠醚是一类大环多醚化合物,其分子结构呈环状,环上均匀分布...
在高考备考化学试卷里,经常会遇到含钯的催化剂。本文将就钯...
在离子晶体中存在离子极化现象,使得离子键带有一定共价键的...
【情境】:你注意到我们每天都离不开的水有什么反常之处吗?...
氢键的大小(强度)可以通过多种因素来比较,这些因素包括氢键...
...