
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、知识精讲
1.硼
硼单质有晶体硼和无定形硼两种,晶体硼相当稳定,无定形硼比较活泼,能发生如下反应:
(1)高温下,与N2、S、X2等单质反应,如2B+N2 2BN。
2BN。
(2)高温下同金属反应生成金属硼化物。
(3)赤热下,与水蒸气反应,2B+6H2O(g) 2B(OH)3+3H2。
2B(OH)3+3H2。
(4)与热的浓硫酸或浓硝酸反应,2B+3H2SO4(浓) 2H3BO3+3SO2↑,B+3HNO3(浓)
2H3BO3+3SO2↑,B+3HNO3(浓) H3BO3+3NO2↑。
H3BO3+3NO2↑。
2.硼酸(H3BO3)
(1)一元弱酸,H3BO3+H2O H++[B(OH)4]-。
H++[B(OH)4]-。
(2)H3BO3受热时会逐渐脱水,首先生成偏硼酸(HBO2),继续升温可进一步脱水生成四硼酸(H2B4O7),更高温度时则转变为硼酸的酸酐(B2O3)。
3.硼氢化钠(NaBH4)
硼氢化钠中的氢元素为-1价,具有还原性,故其可用作醛类、酮类和酰氯类的还原剂:
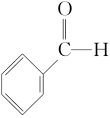 NaBH4
NaBH4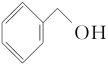 。
。
4.硼砂(Na2B4O7·10H2O)
(1)制备:将偏硼酸钠溶于水形成较浓溶液,然后通入CO2调节pH,浓缩结晶分离出硼砂:
4NaBO2+CO2+10H2O===Na2B4O7·10H2O+Na2CO3。
(2)将硼砂溶于水,用硫酸溶液调节pH,可析出溶解度小的硼酸晶体:
Na2B4O7+H2SO4+5H2O===4H3BO3↓+Na2SO4。
二、专题精炼
1.NaBH4与FeCl3反应可制取纳米铁:2FeCl3+6NaBH4+18H2O===2Fe+6NaCl+6H3BO3+21H2↑,下列说法正确的是( )
A.该反应中氧化剂只有FeCl3
B.NaBH4的电子式为
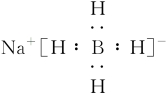
C.NaBH4不能与水发生反应
D.该反应中每生成1 mol Fe转移电子3 mol
答案 B
解析 反应2FeCl3+6NaBH4+18H2O===2Fe+6NaCl+6H3BO3+21H2↑中,FeCl3中的Fe由+3价降低到0价,水中部分H由+1价降低到0价,所以该反应中氧化剂为FeCl3和H2O,A项错误;NaBH4由钠离子与BH4-构成,为离子化合物,则其电子式为
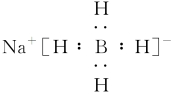 ,
,
B项正确;NaBH4中H为-1价,水中H为+1价,两者发生归中反应可生成氢气,C项错误;题述氧化还原反应中,化合价升高的只有NaBH4中的H,由-1价升高到0价,可据此判断电子转移数目,每生成1 mol Fe,消耗3 mol NaBH4,转移电子12 mol,D项错误。
2.按要求回答问题
(1)[2019·全国卷Ⅰ,26(3)]根据H3BO3的解离反应:H3BO3+H2O H++B(OH)4-,Ka=5.81×10-10,可判断H3BO3是________酸。
H++B(OH)4-,Ka=5.81×10-10,可判断H3BO3是________酸。
(2)[2015·全国卷Ⅰ,27(1)(6)]写出Mg2B2O5·H2O与硫酸反应的化学方程式:___________________________。
单质硼可用于生产具有优良抗冲击性能的硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程:_____________________。
(3)[2015·安徽理综,27(2)]请配平化学方程式:______NaBO2+______SiO2+______Na+______H2===____NaBH4+______Na2SiO3。
(4)[2014·重庆理综,11(2)]NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为_____________________。
答案 (1)一元弱 (2)Mg2B2O5·H2O+2H2SO4 2MgSO4+2H3BO3 2H3BO3
2MgSO4+2H3BO3 2H3BO3 B2O3+3H2O、B2O3+3Mg
B2O3+3H2O、B2O3+3Mg 2B+3MgO (3)1 2 4 2 1 2
2B+3MgO (3)1 2 4 2 1 2
(4)NaBH4+2H2O===NaBO2+4H2↑
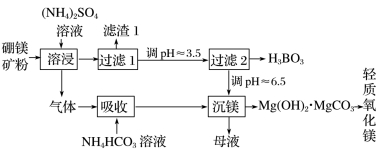
3.硼、镁及其化合物在工农业生产中应用广泛。已知硼镁矿的主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O。一种利用硼镁矿制取金属镁及粗硼的工艺流程如图所示:
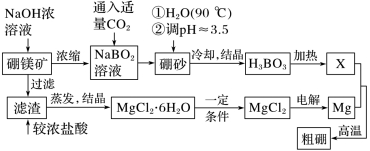
(1)写出硼元素在元素周期表中的位置:________________。
(2)将硼砂溶于水后,用硫酸调节溶液的pH≈3.5以制取硼酸(H3BO3),该反应的离子方程式为_________________。
(3)由MgCl2·6H2O制备MgCl2时,一定条件是_______________________。
(4)制得的粗硼在一定条件下反应生成Bi3,Bi3在一定条件下受热分解可以得到纯净的单质硼。0.200 0 g 粗硼制成的Bi3完全分解,将生成的I2配制成100 mL 碘水,量取10.00 mL 碘水于锥形瓶中,向其中滴加几滴淀粉溶液,用0.300 0 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。(提示:I2+2S2O32-===2I-+S4O62-)滴定终点的现象为_____________,该粗硼样品的纯度为________%。
(5)H3BO3[也可写成B(OH)3]可以通过电解NaB(OH)4溶液的方法制备。工作原理如图所示。
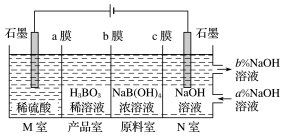
①b膜为__________(填“阴离子”或“阳离子”)交换膜,写出产品室发生反应的离子方程式:_____________________,理论上每生成1 mol H3BO3,N室可生成________L(标准状况)气体。
②N室中,进口和出口的溶液浓度大小关系为a%______(填“>”或“<”)b%。
答案 (1)第二周期ⅢA族 (2)B4O72-+2H++5H2O===4H3BO3↓ (3)在HCl氛围中加热 (4)滴加最后一滴Na2S2O3溶液,锥形瓶中溶液蓝色褪去,且半分钟内不恢复原色 99 (5)①阴离子 H++B(OH)4-===H3BO3+H2O 11.2 ②<
解析 (3)因MgCl2在蒸干灼烧时会发生水解,其水解的化学方程式为MgCl2+2H2O Mg(OH)2+2HCl,所以为了防止氯化镁水解生成氢氧化镁,需要在HCl氛围中加热。
Mg(OH)2+2HCl,所以为了防止氯化镁水解生成氢氧化镁,需要在HCl氛围中加热。
(4)消耗的Na2S2O3的物质的量为0.300 0 mol·L-1×0.018 L=0.005 4 mol,根据关系式: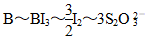 得,n(B)=
得,n(B)=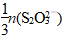 =0.001 8 mol,
=0.001 8 mol,
则该粗硼样品中B的物质的量=0.001 8 mol×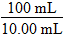 =0.018 mol,则硼的质量为11 g·mol-1×0.018 mol=0.198 g,该粗硼样品中硼的质量分数为
=0.018 mol,则硼的质量为11 g·mol-1×0.018 mol=0.198 g,该粗硼样品中硼的质量分数为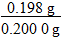 ×100%=99%。
×100%=99%。
(5)①产品室可得到H3BO3的原因是M室的H+穿过阳离子交换膜扩散至产品室,原料室的B(OH)4-穿过阴离子交换膜扩散至产品室,二者反应生成H3BO3,其离子方程式为H++B(OH)4-===H3BO3+H2O,所以b膜应为阴离子交换膜。阴极的电解液为氢氧化钠溶液,所以N室的电极反应式为2H2O+2e-===H2↑+2OH-,生成1 mol H3BO3时,需要M室和原料室分别转入1 mol H+、1 mol B(OH)4-,则需转移1 mol e-,所以N室可生成0.5 mol 氢气,其体积在标准状况下为11.2 L。②N室溶液中氢氧根离子浓度增大,Na+从原料室通过阳离子交换膜进入N室,故N室进口溶液浓度比出口的小,即a%<b%。
4.[2019·全国卷Ⅰ,26(1)(2)(4)]硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
回答下列问题:
(1)在95℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为___________________。
(2)“滤渣1”的主要成分有______________________。
为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是________。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为__________________________,
母液经加热后可返回________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是________。
答案 (1)NH4HCO3+NH3===(NH4)2CO3
(2)SiO2、Fe2O3、Al2O3 KSCN溶液
(4)2Mg2++3CO32-+2H2O===Mg(OH)2·MgCO3↓+2HCO3-[或2Mg2++2CO32-+H2O===Mg(OH)2·MgCO3↓+CO2↑] 溶浸 高温焙烧
解析 (1)由流程图加入物质可知,“溶浸”时产生的气体只能是NH3,NH3与NH4HCO3反应生成用于“沉镁”的物质只能是(NH4)2CO3。
(2)由流程图可知,在过滤获取H3BO3之前没有除Fe3+、Al3+的步骤,推知氧化铁、氧化铝在“溶浸”时没有溶解,而二氧化硅不溶于硫酸铵溶液,因而滤渣1的主要成分是二氧化硅、氧化铁、氧化铝。检验Fe3+的试剂可选用KSCN溶液。
(4)“沉镁”中,结合反应物有Mg2+、CO32-,生成物为Mg(OH)2·MgCO3,依据离子方程式书写要求,即可写出方程式。母液含硫酸铵,可以将母液返回“溶浸”工序循环使用,体现绿色化学理念和环境保护思想。碱式碳酸镁转化成轻质氧化镁,联系碳酸镁、氢氧化镁受热都能分解生成氧化镁。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【导读】“强酸制弱酸”是复分解反应的常见规律,其本质是强酸电离出的H更易与弱酸根...
在高中化学中,很多同学从初中就学习了复分解反应, 都知道复分解反应中“强酸制弱酸...
1.水银:汞Hg 2.过氧一硫酸:过氧硫酸过硫酸 H 2 SO 5 3.白金:主要成分铂 Pt 4.苯:C...
...
元素种类 对应物质的常考易错点 N 性质:(1)浓HNO 3 和Cu(足量)在反应时,随反应进行...
例题1:浓硫酸与金属反应的条件 题目:常温下,浓硫酸能否与金属铁发生反应? 错误答...