
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.
氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性和还原性的物质,对不具有氧化性或还原性的物质,可进行间接测定。氧化还原反应较复杂,常伴有各种副反应,反应速度较慢,因此,氧化还原滴定法要注意选择合适条件使反应能定量、迅速、完全进行。
(1)滴定反应必须按一定的化学反应式定量反应,且反应完全,无副反应。
(1)自身指示剂如KMnO4滴定H2C2O4时,KMnO4既是标准溶液又是指示剂。
(2)特殊指示剂如用于碘量法中的淀粉溶液,本身不参与氧化还原反应,但它能与氧化剂作用产生特殊的颜色,因而可指示终点。
(3)氧化还原指示剂
(1)基本原理和条件高锰酸钾法是以具有强氧化能力的高锰酸钾做标准溶液,利用其氧化还原滴定原理来测定其他物质的滴定分析方法。
强酸性溶液中MnO4-+8H++5e-→Mn2++4H2O
(2)测定方法:
标定反应为:2MnO4-+5C2O42-+16H+==2Mn2++10CO2↑+8H2O
(4)标定时注意事项:
②温度:近终点时加热至65℃,促使反应完全
①直接碘量法(或碘滴定法)直接碘量法是直接用I2标准溶液滴定还原性物质,又叫做碘滴定法。直接碘量法只能在酸性、中性或弱碱性溶液中进行。直接碘量法可用淀粉指示剂指示终点。直接碘量法还可利用碘自身的颜色指示终点,化学计量点后,溶液中稍过量的碘显黄色而指示终点。
(3)标准溶液的配制和标定
①碘标准溶液(0.05mol/L)的配制和标定
②硫代硫酸钠标准溶液(0.1mol/L)的配制和标定
在Na2S2O3溶液的配制过程中应采取下列措施:
第一、为了除去水中的微生物,用新煮沸冷却后的蒸馏水配制。
第二、配制时加入少量的Na2CO3,使溶液呈弱碱性,可减少溶解在水中的CO2、O2和杀死微生物。
第三、将配制溶液置于棕色瓶中,放置8~10天,待其浓度稳定后再标定,但若发现溶液浑浊,需重新配制。
标定方法为:精密称取在120℃干燥至恒重的基准物质重铬酸钾0.15g,置碘量瓶中,加水50mL 溶解,加碘化钾2.0g,轻轻振摇,加稀硫酸40mL,摇匀,密塞,水封后在暗处放置10分钟,取出加水50mL 稀释,用待标定Na2S2O3溶液滴定至近终点时,加淀粉指示剂3mL,继续滴定至溶液由蓝色变亮绿色为终点。
滴定反应为:
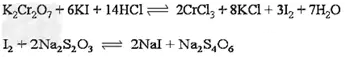

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
什么是“软硬酸碱理论”,1963 年,拉尔夫・皮尔逊提出软硬酸...
水溶液中NH水解显酸性,CO、HCO水解显碱性,二者会发生“相互促...
在基础化学中,我们常被告知:盐类水解通常是微弱且可逆的。...
一般来说,溶解度大的物质易转化为溶解度小的物质。那反过来...
一.定义 1.pH pH=–log[H] pH是衡量溶液整体酸碱度的指标,具体指溶...
溶解度(Solubility)与溶度积常数(Solubility Product Constant, ksp密切...