
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1问题提出
关于“等电子原理”的考査已成为新课改省区高考 化学的要求之一,江苏高考化学科说明中也有明确的要 求:了解“等电子原理”的含义,能结合实例说明“等电 子原理”的应用。但是我省使用的两套教材中,关于“等 电子原理”都是轻描淡写,人教版只用三行六列的表和 三行半的文字描述,苏教版仅是用资料卡片来介绍的, 显然易造成学生理解不深刻、应用不熟练、答题错误 多等后果。因此在高三化学复习备考中师生应高度重 视、认真研究、把握内涵、精心备考。笔者在两轮的高 三复习中仔细琢磨,反复推敲,有所感悟,现和同行交 流如下。
2问题探讨
江苏高考化学科说明的要求是:了解“等电子原理” 的含义,能结合实例说明“等电子原理”的应用。对这 一考查要求,可理解为:①考生必须能正确创设某种微粒的等电子体。②考生必须能结合实例说明“等电子原 理”的应用。为此笔者就两个方面作了相应的思考和探 讨。
2.1 如何正确创设微粒的等电子体
2.1.1策略1替换思维法
根据同族元素的原子具有相同的价电子数,可进 行相应的替换,举例思考如下。例:分别写出与CF4、 NH3、H2O互为等电子体分子的化学式(见表1)。
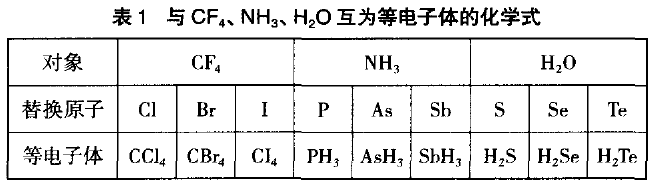
应用替换思维,学生能自然地、熟练地寻找到微粒 的等电子体。再如,将CO2中的两个O原子替换为两个 S,可得等电子体CS2,也可将一个O原子替换为一个S, 可得等电子体COS,将SCN-中的S原子替换为O,可 得等电子体CNO-或NCO-等。
2.1.2策略2组合思维法
根据“等电子原理”原理,先满足原子总数相同, 将相关的原子进行有机组合,得到各种不同的“原子 团”。再根据价电子总数相等的要求,适当给电子或去 电子,便可创设形式不同的等电子体。举例思考探讨如 下。
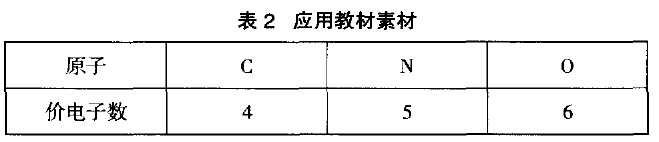
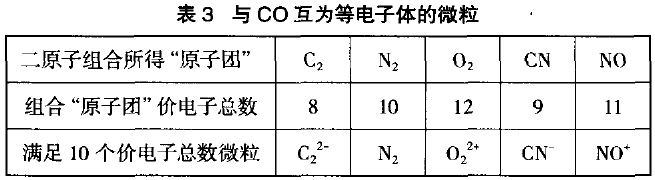
设问:如何创设与CO互为等电子体的微粒?思考探讨为:①先简单计算得CO是二原子,10个价电子微 粒。②用C、N、O三种原子有机组合满足二原子组合有五种。③将所得的五种组合,适当加、减电子可得5种等电子体(见表3)。
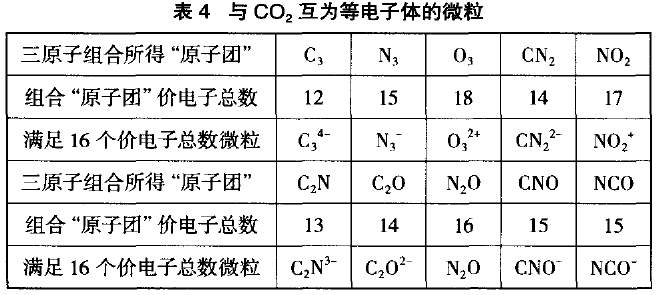
还可用相似的思维,创设与CO2互为等电子体的 微粒(见表4)。
2.1.3策略3原子团电荷移动思维法
设问:分别写出与CO32-、PO43-互为等电子体的微粒的化学式___________ 。本题可创设如下:可将CO32-所带的两个负电荷看着“两个电子”,然后将这“两个电子”逐步移向中心原子碳上便可得相应的等电子体。 即当移下“一个电子”到中心原子碳上时,原子团只带 一个单位负电荷,中心原子上的价电子就增加一个变为 5个,这时中心原子碳就可看为氮原子,自然得等电子体NO3-。当移下“两个电子”到中心原子碳上时,原子 团就不再带电荷,中心原子上的价电子就增加两个变为 6个,这时中心原子碳就可看为硫原子,自然得等电子体SO3。同理将PO43-移下“一个电子”可得SO42-,再 移下“一个电子”可得ClO4-。
2.2 “等电子原理”的应用
当熟练应用以上3种思维创设等电子体后,因等 电子体间具有相似的化学键特征、相似的化学结构,因 此能由熟悉的微粒去理解不熟悉的微粒。如N3-与CO2互为等电子体,那么请回答N3-的电子式、中心氮原子 的杂化类型、微粒的空间构型、键的类型等,因CO2的 电子式为: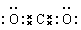 ,CO2分子中碳原子采用sp杂化,分子的空间构型为直线形等。根据等电子体原理学生便能顺利迁移回答写出N3-的电子式为
,CO2分子中碳原子采用sp杂化,分子的空间构型为直线形等。根据等电子体原理学生便能顺利迁移回答写出N3-的电子式为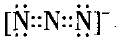 、N3-中心 氮原子也采用sp杂化、空间构型也为直线形、1 mol N3- 中含有的π键数目为2×6.02×l023个。再如2010江苏 高考化学第21题,已知CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为______ ; 1 mol O22+中含有的π键数目为_____ 。学生就能正确写出的O22+电子式
、N3-中心 氮原子也采用sp杂化、空间构型也为直线形、1 mol N3- 中含有的π键数目为2×6.02×l023个。再如2010江苏 高考化学第21题,已知CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为______ ; 1 mol O22+中含有的π键数目为_____ 。学生就能正确写出的O22+电子式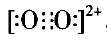 , 1 mol O22+中含有的 π键数目为 2×6.02×l023 个。
, 1 mol O22+中含有的 π键数目为 2×6.02×l023 个。
还须提醒学生,在回答该类问题时,一定要仔细审 题,审清设问要求、审清答题要求等。如,①请写出一种与CN-互为等电子体离子的化学式__________ ,该问学生须注意要写的是离子的化学式,否则易错写为N2或 CO,正确答案可写C22-或O22+或NO+。②请写出一种与氮的最简单氢化物互为等电子体的离子的电子式_____ ,回答该题一要注意创设的对象是氮的最简单氢化物即NH3,二要注意创设的是等电子体应是离子,三 答案必须写为电子式,这样正确结果应写为水合氢离 子的电子式或甲基负离子的电子式才吻合题设要求。③ 请写出写出一种与CO32-互为等电子体且属于非极性分子的微粒的化学式________ ,同样要注意一是非极性分子,二是要写化学式。正确答案为SO3或BF3。
3感悟
通过对“等电子原理”以上探讨,学生收获的不仅 仅是“等电子原理”这一纯粹的知识,而注重的是寻找 等电子的过程,在过程中培养了学生的一种学科思维 方式,懂得了举一反三,触类旁通。潜移默化地帮助学 生更好地理解化学学科思想,提升了化学学科的思维 力。这样的探析是独创的、敏捷的、灵动的,在探析中 体验到成功的乐趣,学会了思考、学会了学习,真正实现了 “教是为了不教”。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。分析: 依据价层电子对数计算公式分析, 可得价层电子对数=5=[2+3],故有2个配位原子...
...
比较键角大小分析思路: 参照以下顺序来判断键角大小 ①先从中心原子的杂化类型来入手...
顺反异构中,分子的对称性、极性以及熔点和沸点存在以下差异: 1.对称性比较 反式异构...
01 — 概念 在多原子分子(就是三个或三个以上的原子构成的分子)中,如有相互平行的p...
含有共价键的物质中相邻两键之间的夹角称为键角。键角是决定物质分子空间构型的主要因...