
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在人民教育出版社化学室编著的,全日制普通高 级中学教科书(必修)《化学》第一册中,这样描述质量数:质子和中子的相对质量都近似为1,如果忽略电 子的质量,将原子核内所有的质子和中子的相对质量 取近似整数值加起来所得的数值,叫做质量数,用符 号A表示。在多年教学中,笔者发现许多师生关于 “质量数”的理解常有以下两个误区。
误区一:认为某原子的质量数在数值上一定小于其相对 原子质量。其实不然,比如下列原子的相对原子质量:3517Cl为 34. 968853,3717Cl为 36. 965903,168O为 15. 994915,178O为16. 999132,188O为 17. 999160 均小于 其质量数。
错因分析:许多人误以为:某核素一个原子质量 =Z个质子质量+ N个中子质量十Z个核外电子质 量,则该原子相对原子质量=(Z个质子质量+ N个)中子质量+ z个核外电子质量)/(1个126C原子质量 的1/12);其相对原子质量=Z个质子相对质量+ N 个中子相对质量+Z个核外电子相对质量,把质子相对质量1. 00728和中子相对质量1. 00867都近似为1, 忽略电子的质量,将原子核内所有的质子和中子的 相对质量取近似整数值加起来,可得出:该原子相对原子质量近似等于Z+N,即质量数为近似相对原子质量,经 上述近似取值后质量数的数值当然应该比相对原子 质量小。
实际上,某核素一个原子质量并不等于Z个质子 质量+N个中子质量+ Z个核外电子质量;原子核的质量比Z个质子质量与N个中子质量之和要小,这 是因为:当质子与中子在形成原子核时要放出巨大的 能量,根据爱因斯坦质能方程:E= mc2,则ΔE=Δmc2,当一个系统的能量减少时,其质量也相应减 少,即质子与中子在形成原子核放出巨大能量的同时,必然伴生着原子核的质量亏损,例如原子,其 质子与中子相对质量之和为1. 00728 + 1. 00867 =2.01595,而11H的相对原子质量为2. 01355,小于其 质子与中子质量之和,其差别就是因为质量亏损造成 的,因此原子核的质量要小于质子与中子的质量之 和,这也是3517Cl,3717Cl,168O,178O,188O等原子的相对原子 质量小于质量数的原因,但要注意并不是所有原子的质量数都大于其相对原子质量,比如21H的相对原子质量为2. 01355>2,11H的相对原子质量是1. 007825 >1。
误区二 :有些学生误把质量数当作元素的近似相对原子质量。实际上,质量数可以认为是某核素的近似相对 原子质量,但不能当作元素的近似相对原子质量。
错因分::有些学生把某核素的相对原子质量与 元素的相对原子质量混淆了,或者忽略了元素大都存 在同位素的事实.实际上,除Na、F等少数元素为单 一核素元素外,绝大多数元素均存在两种或两种以上 的同位素;元素的相对原子质量实际上是按各同位素 的丰度(即在自然界的原子个数百分比)算得的平均值。例如,天然氢由两种稳定同位素11H、21H组成,它 们的相对原子质量分别是1. 007825、2. 01355,它们 在自然界的丰度分别是99. 985%、0.015%,则氢元素的相对原子质量计算式为007825×99. 985% +2.01355×0. 015%=1. 00797。
附:针对性练习
已知某元素X一种同位素的质量数为A,中 子数为N,则下列判断不正确的是( )。
A.这种同位素的符号可以表示为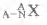
B.A可以代表这种同位素的近似相对原子质量
C. A小于X元素的相对原子质量
D. A不能代表X元素的相对原子质量
正确答案:C.
以上是笔者关于“质量数”的一点粗浅的认识,希 望对大家有益。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
本文将给出基于八隅律的电子式的书写步骤。与以往教学不同之...
氯离子(Cl)的半径大于铯离子(Cs)!!!课本上没有错哦!...
含氧酸是酸中的主角,常见的含氧酸中,有高某酸、正某酸、亚...
一、常见三种原子半径的标准 首先我们说说原子半径有几种不同...
【导读】键长和键能的关系在化学中通常表现为反比规律:键长...
...