
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
已知:二元弱酸碳酸的解离常数:Ka1=4.2×10-7;Ka2=5.6×10-11。
(一)碳酸发生两步解离:
H2CO3 HCO3-+H+; HCO3-
HCO3-+H+; HCO3- H++ CO32-
H++ CO32-
∵Ka1≥100Ka2,说明H2CO3二级解离可忽略。
∴H2CO3以一级解离为主。
(二)Na2CO3溶液发生两步水解:
CO32-+H2O HCO3-+OH-; HCO3-+H2O
HCO3-+OH-; HCO3-+H2O H2CO3+OH-
H2CO3+OH-
根据共轭酸碱理论:
Kh1=Kw/Ka2=1.79×10-5; Kh2=Kw/Ka1=2.38×10-9
∵Kh1≥100 Kh2,说明Na2CO3二级水解可忽略。
∴Na2CO3溶液以一级水解为主,溶液显碱性。
(三)NaHCO3溶液发生水解和解离两个过程,应抓主要矛盾分析:
Kh2=Kw/Ka1=2.38×10-9;Ka2=5.6×10-11
∵Kh2>Ka2
∴NaHCO3溶液中HCO3-水解程度大于解离程度。以水解为主,溶液显碱性。
【已知】25℃碳酸在水溶液中的解离常数:Ka1=4.2×10-7;Ka2=5.6×10-11。
求:(1)25℃时0.01mol/L~0.1mol/L 碳酸钠溶液pH;(2)25℃时0.01mol/L~0.1mol/L 碳酸氢钠溶液pH。
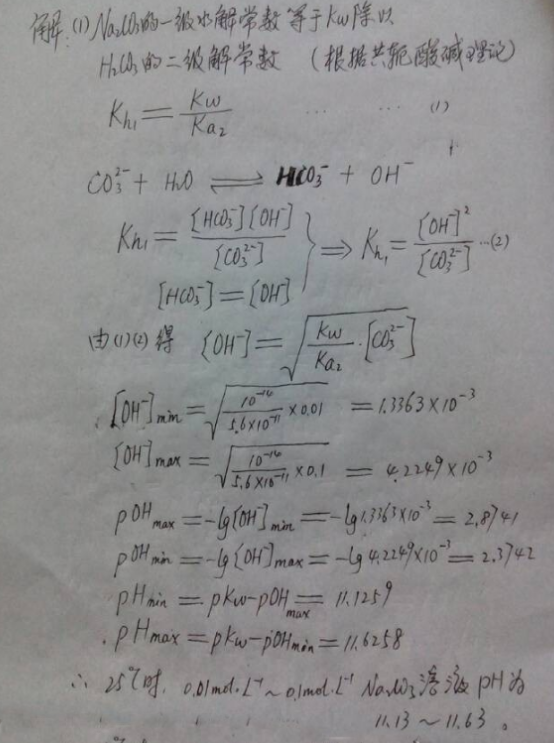


 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
什么是“软硬酸碱理论”,1963 年,拉尔夫・皮尔逊提出软硬酸...
水溶液中NH水解显酸性,CO、HCO水解显碱性,二者会发生“相互促...
在基础化学中,我们常被告知:盐类水解通常是微弱且可逆的。...
一般来说,溶解度大的物质易转化为溶解度小的物质。那反过来...
一.定义 1.pH pH=–log[H] pH是衡量溶液整体酸碱度的指标,具体指溶...
溶解度(Solubility)与溶度积常数(Solubility Product Constant, ksp密切...