
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、强酸溶液氢离子浓度:
HCl溶液中,完全电离,因此[H+]=[Cl-]=[HCl]
二、弱酸溶液氢离子浓度:
醋酸CH3COOH (经常简写做HAc)溶液中存在着平衡:
HAc+H2O⇌H3O++Ac-
平衡常数表达式:
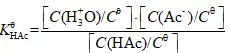
KHAc解离平衡常数,[H3O+]、[Ac-]和[HAc]分别表示H3O+、Ac-和HAc的平衡浓度。
HAc⇌H++Ac-
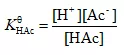
例1、298K时HAc的Ka=1.76×10-5计算0.10mol·L-1HAc溶液的[H+]浓度和解离度。
解:设平衡时H+离子浓度为x
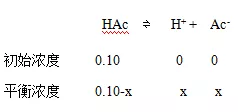
Ka=x2/(0.10-x)
当α<5%时或c酸/Ka≥500,则c酸≈[酸],即0.10-x≈0.10,
Ka=x2/(0.10)=1.76×10-5,
[H+]=x=1.33×10-3mol·L-1
α=[H+]/c酸×100%=1.33×10-3/0.1×100%=1.33%
例2、计算0.010 mol·L-1的H2SO4溶液中各离子的浓度,已知H2SO4的K2为1.2×10-2。
解:H2SO4第一步完全电离,所以,[H+] = [HSO4-] = 0.010 mol·L-1
设第二步电离平衡时溶液中SO42-的浓度为xmol·L-1
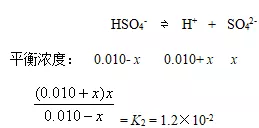
c/K2< 400
x2+0.22x- 0.00012 = 0
解得x= [SO42-] = 4.5×10-3mol·L-1
[H+] = 0.010 + 0.0045 = 1.45×10-2(mol·L-1)
[HSO4-] = 0.010 - 0.0045 = 0.0055 mol·L-1
例3、0.20mol/L H2SO4溶液和0.40mol/L Na2SO4溶液等体积混合后所得溶液的pH.已知:Ka2=1.2×10-2
解:
0.20mol/L H2SO4溶液和0.40mol/L Na2SO4溶液等体积混合后所得溶液起始浓度为:
c(H2SO4)=0.10mol/L; c(Na2SO4)=0.20mol/L.
由于H2SO4第一步完全电离,所以由此步电离产生的H+浓度为0.10mol/L;第二步的Ka2=1.2×10-2,为弱酸解离,所以H2SO4溶液和Na2SO4溶液等体积混合时会发生反应:
H2SO4+SO42-=2HSO4-
由于H2SO4比SO42-浓度小,所以SO42-过量,反应后SO42-浓度为0.20-0.10=0.10mol/L;生成的HSO4-浓度为0.20mol/L.如此,计算HSO4-体系的pH,相当于一元弱酸强碱盐缓冲液(HSO4--SO42-)中H+浓度计算。
设第二步电离平衡时溶液中SO42-的浓度为xmol·L-1
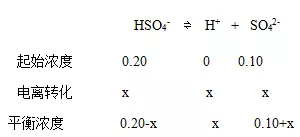
Ka2=x×(0.10+x)/(0.20-x)=1.2×10-2
c×Ka=0.20×1.0×10-2>20Kw,所以水的解离可以忽略,
由HSO4-电离产生的[H+] = [SO42-]=x。
c/Ka=0.20/1.0×10-2<400,HSO4-解离度较大,不能忽略解离生成SO42-而消耗的HSO4-量,即 0.20-x≠0.20
解上述方程,x=0.016mol·L-1
此时,[HSO4-] =(0.20-0.016)mol·L-1=0.184mol·L-1
[SO42-]=0.10+0.016mol·L-1=0.116mol·L-1
计算HSO4-体系的pH,相当于一元弱酸强碱盐缓冲液(HSO4--SO42-)中H+浓度计算。
pH=PKa2-lg[c(HSO4-)/c(SO42-)]
pH=-lg1·0×10-2-lg[(0.20-x)/(0.10+x)]=1.79
思考:
(1)若近似计算:
Ka2=x×(0.10+x)/(0.20-x)=1.2×10-2
0.20-x≈0.20;0.10+x≈0.10
Ka2=x×(0.10)/(0.20)=1.2×10-2
x=2.4×10-2mol·L-1;
pH=1.62
(2)若按中学计算方法,H2SO4完全电离,[H+] =2[H2SO4]
c(H2SO4)=0.10mol/L;[H+] =0.20mol/L
pH=0.69
例4:将0.20 mol·L-1盐酸和0.20 mol·L-1H2C2O4等体积混合,求溶液中的C2O42-和HC2O4-的浓度。
解:由于H2C2O4的K1/K2> 100,求HC2O4-的浓度时只考虑第一步电离。
0.20 mol·L-1盐酸和0.20 mol·L-1H2C2O4等体积混合后,盐酸浓度为0.10 mol·L-1和0.10 mol·L-1H2C2O4
设平衡时溶液中HC2O4-的浓度为xmol·L-1;C2O42-的浓度为ymol·L-1。
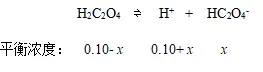


 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
所谓缓冲溶液,是指能维持溶液的酸度,使溶液的pH不因外加少...
...
什么是PH?PH是拉丁文“Pondushydrogenii”一词的缩写(Pondus=压强、压...
一、水的离子积计算 水的离子积( K w )是一个使用频率较高的化...
多元弱酸在水中是分步电离的,因此,计算时应考虑电离 / 反应...
强酸溶液氢离子浓度: HCl 溶液中,完全电离,因此 [H + ]=[ Cl ...