
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氯气的制取是中学化学实验室必做的实验。按照传统的方法,一般采用浓盐酸与MnO2或KMnO4共热来制备氯气。该反应原理,即MnO2+4HCl(浓)==Cl2+MnCl2+H2O或2KMnO4+16HCl(浓)==5Cl2+3KCl+2MnCl2+8H2O为舍勒最初发现氯气时的理论依据,已有数百年的历史。但是这种方法制得的氯气不经过洗气就会含有较多氯化氢气体;并且由于要求浓盐酸的浓度在10mol/L以上,故其利用率就大大降低;其他还有诸如生成的氯气无法定量、实验装置比较繁琐等缺点。
随着科学的不断发展,整个世界也始终在经历一个简便取代繁琐的优化过程。为了克服传统制氯实验的缺点,以另一种更好的方法取代它,本人选择了这一课题,并对照传统实验,提出了以下几点新实验应该具有的优点:
1)制取氯气的同时不能或仅有极少量的杂质气体生成; 2)药品的利用率要高;3)要能够定量制取氯气; 4)实验装置要尽可能简便。
为了达到以上的目的,本人进行了一系列实验。
2.实验方案的设计和实施及结果分析
实验I
1)原理:NaClO+NaCl+H2SO4==Cl2+Na2SO4+H2O
2)实验器材
a.实验材料:次氯酸钠溶液(C.P)、氯化钠固体、40%硫酸、氢氧化钠溶液
b.实验仪器:125ml蒸馏烧瓶*1,60ml分液漏斗*1,100ml烧杯*1,125ml集气瓶若干;铁架台、烧瓶夹、十字夹各一;导管、乳胶管、单孔和双孔橡胶塞若干
3)实验方法:
(1)将次氯酸钠溶液30ml和氯化钠10克加入蒸馏烧瓶中;
(2)将40%硫酸加入分液漏斗;
(3)在烧杯中加入一定量的氢氧化钠溶液;
(4)按制取CO2方法连接仪器(见图);
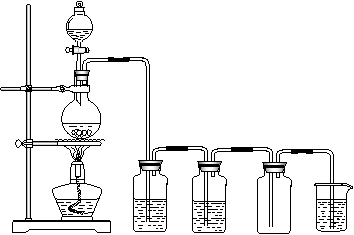
(5)检查装置的气密性;
(6)将硫酸溶液逐滴加入次氯酸钠溶液和氯化钠的混合物中;
(7)在集气瓶中收集氯气。
4)实验结果和分析
硫酸溶液滴入混合液中反应程度较小,速度慢,氯气产量少,集气瓶中很难收满氯气,实验改进效果不理想。造成这种情况的原因应该有三:其一,次氯酸钠溶液的浓度太低(活性氯>=5%);其二,次氯酸钠水解使溶液呈强碱性,其中的氢氧根离子抢先与氢离子反应,浪费了部分硫酸,故当硫酸刚开始加入到混合物中时无明显现象;其三,此反应系溶液与溶液反应,不经搅拌反应难以彻底。要达到更佳的效果,就要在药品上下工夫,寻找一种水解后溶液呈弱碱性的固体药品来代替次氯酸钠溶液。
实验II
1)原理:Ca(ClO)2+CaCl2+2H2SO4==2CaSO4+2Cl2+2H2O
2)实验器材
a.实验材料:漂粉精片(每片含0.2克有效氯)、40%硫酸、氢氧化钠溶液
b.实验仪器:同实验I
3)实验方法:
(1)将漂粉精片10片放入蒸馏烧瓶中;
(2)--(5)同实验I方法
(6)将硫酸溶液逐滴加入蒸馏烧瓶中使之与漂粉精片反应;
(7)同实验I。
4)实验结果和分析
硫酸溶液滴入烧瓶与漂粉精片接触后,固体表面产生大量气泡,有黄绿色气体产生。但随着时间的推移,反应逐渐趋于缓慢,无论是再加入硫酸还是氯化钠溶液,反应速度都未就此加快。说明其速度的减缓并非因为氢离子浓度或氯离子浓度的减小。反观此反应的方程式,联系到硫酸与块状碳酸钙作用时生成的硫酸钙会包被在碳酸钙表面阻碍反应的深入进行这一事实,推断这一反应速度的减缓亦系生成的硫酸钙包覆在漂粉精片表面所致。要解决这个问题就要用其他的酸代替硫酸。
实验III
1)原理:Ca(ClO)2+4HCl==2Cl2+CaCl2+2H2O
2)实验器材
a.实验药品:漂粉精片、1mol/L盐酸
b.实验仪器:同实验I
3)实验方法:(1)将漂粉精片10片放入蒸馏烧瓶中;
(2)在分液漏斗中加入1mol/L盐酸;
(3)---(5)同实验I;
(6)将盐酸逐滴滴入烧瓶中;
(7)同实验I。
盐酸滴入烧瓶与漂粉精片接触反应后,即产生大量黄绿色气体,气泡较为稳定、持续地从固体表面产生,在集气瓶中可得较纯净的氯气。反应趋于停止时再加入盐酸能继续生成氯气。
实验III的方法较为成功地克服了实验II中生成硫酸钙阻碍反应进行的缺点,实验Ⅲ为固体与液体反应,也克服了实验Ⅰ中液体与液体反应不彻底、产量小的缺点。其产气量大,可做氯气的稳定气源。
由于其反应只需1mol/L的稀盐酸于常温下就可发生,与传统方法须用浓盐酸在加热条件下制氯气相比,不仅避免了大量氯化氢气的杂质性干扰,而且大大提高了盐酸的利用率;另外,由于该反应是较为彻底进行的,因而只需通过对化学方程式各物质的摩尔数做简单的计算即能使反应产生的氯气定量;加上该反应所需装置简单,因而该方法不论是在氯气的制备和系列实验还是在有机物的卤代反应中都显而易见地具有实用价值,较全面地克服了传统方法的缺点,较之传统方法有较大的优势性,可以说是代替它的制氯新途径。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
通常老师们照顾到你们现阶段的认知,会说要想把CCl 4 中的碘分...
―、问题的提出 《中学化学教学参考》2011年第1 、2合期“必修...
教材在处理有关Cl 2 的漂白原理的问题时,通过一下实验说明:...
盐酸的浓度如下分类: 程度 密度(克/立方厘米) 质量分数(...
溴分子或碘分子属于非极性分子(所谓非极性分子就是对称性很很...
...