
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在非金属元素中,除零族元素外,多数都能与氢以共价键结合,形成氢化物。其中,C、Si、B等还能形成一系列氢化物。这里要讨论的是非金属最简单的氢化物,如下表所列:
| IVA | VA | VIA | VIIA |
| CH4 | NH3 | H2O | HF |
| SiH4 | PH3 | H2S | HCl |
| AsH3 | H2Se | HBr | |
| H2Te | HI |
以上氢化物在通常状况下,除H2O是液体,其它都是气体。它们的熔点和沸点都很低。
下面简单介绍非金属氢化物的化学性质。
1.气态氢化物的热稳定性
非金属气态氢化物的热稳定性与非金属性强弱有关。一般情况下,元素的非金属性愈强,愈容易与氢化合,生成的氢化物愈不容易热分解。所以说,周期表中的元素,从左到右、从下到上,形成的氢化物稳定性逐渐增强。例如,HI在300℃左右开始分解,而HF1000℃时几乎不分解。
2.氧化还原性
多数非金属氢化物都具有还原性,能与一些氧化剂反应。
(1)与O2反应,如:
CH4+2O2![]() CO2+2H2O;4NH3+5O2
CO2+2H2O;4NH3+5O2![]() 4NO+6H2O;2H2S+3O2
4NO+6H2O;2H2S+3O2![]() 2SO2+2H2O;
2SO2+2H2O;
(2)与Cl2反应,如:
H2O+Cl2=HClO+HCl;H2S+Cl2=2HCl+S;2HI+Cl2=2HCl+I2
(3)与金属离子反应,如:
2HI+2Fe3+=I2+2Fe2++2H+;H2S+2Fe3+=S↓+2Fe2++2H+
非金属氢化物还原性强弱,也与非金属在周期表中的位置有关。在周期表中,从上到下、从右到左,非金属氢化物的还原性逐渐增强。
3.非金属氢化物的水溶液
有些非金属氢化物能溶于水,在水中电离,使溶液显酸性或显碱性。一般地说,氧族元素,卤族元素形成的氢化物(H2O除外)显酸性,部分氮族元素形成的氢化物显碱性,碳族元素形成的氢化物呈中性。
几种氢化物水溶液的酸碱性
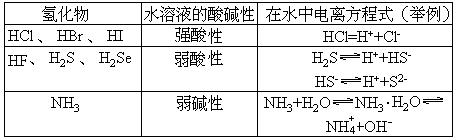
非金属氢化物水溶液的酸碱性强弱,也与元素在周期表中的位置有关。一般地说,从上到下,从左到右,酸性逐渐增强,碱性逐渐减弱。所以,氢碘酸(HI)是非金属氢化物水溶液中酸性最强的。
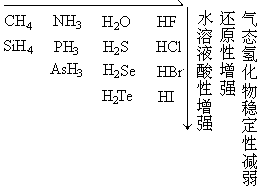
根据以上所述,非金属氢化物的一些规律可以归纳表示如下: 气态氢化物稳定性增强,还原性减弱,水溶液酸性增强

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
本文将给出基于八隅律的电子式的书写步骤。与以往教学不同之...
氯离子(Cl)的半径大于铯离子(Cs)!!!课本上没有错哦!...
含氧酸是酸中的主角,常见的含氧酸中,有高某酸、正某酸、亚...
一、常见三种原子半径的标准 首先我们说说原子半径有几种不同...
【导读】键长和键能的关系在化学中通常表现为反比规律:键长...
...