
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
“氮族元素”一章内容是元素化合物知识的重要内容。学生在学习过程中对这部分内容存在的疑问较多,为便于同学们学习时掌握,笔者对教学过程中学生所存在的疑难问题进行了较为系统的归纳分析。
一、氮气有关疑难点分析
1、N比P元素的非金属性强,为什么氮气却反而比白磷活泼性弱?
答:根据元素周期律可知,氮元素的非金属性比磷元素强。而物质的活泼性与其分子内的化学键有着密不可分的关系。由于氮分子内存在的是N≡N三键,而白磷分子内存在的是P-P单键,氮分子内共价键的键能很大,不易断裂,故N2稳定;白磷分子内共价键的键能较小,易断裂,故白磷分子较活泼。
2、氮气的化学性质很稳定,在常温下,氮气一定不能和任何物质反应吗?
答:在常温下,根瘤菌能将空气中的氮气直接转化为硝酸根离子而被植物吸收。另外,金属锂和氮气反应时,N2直接参与反应,且该反应放热,故在常温下也可进行。
二、氨气和氨水有关疑难点分析
1、为什么氨气极易溶解于水?
答:因为氨分子与水分子很容易通过氢键结合形成NH3·H2O;且H2O和NH3都是极性分子,根据相似相溶原理,由极性分子组成的溶质NH3易溶于由极性分子H2O组成的溶剂,所以氨气极易溶解于水。
2、氨水中含量最多的微粒是NH3吗?
答:不是,因为氨气极易溶解于水,且溶于水的氨气绝大部分与水反应生成了NH3·H2O,NH3·H2O是弱碱,只有极少部分发生电离,所以溶液中含量最多的微粒应是NH3·H2O,而不是NH3。
3、氨水的溶质是NH3·H2O吗?
答:不是,溶于水的氨气虽绝大多数都和水结合以NH3·H2O的形式存在,在计算物质的量浓度时仍以NH3为溶质。
4、氨水是弱电解质溶液,其电解质是NH3吗?
答:不是,氨气的水溶液可导电,主要是因为氨气与水反应生成了NH3·H2O,它可部分电离出自由移动的NH4+和OH-,而NH3本身并不能电离,故其电解质是NH3·H2O,不是NH3,NH3是非电解质。
5、氨气溶于水是有利于水的电离,还是抑制了水的电离?
答:从NH3的电子式可知,n(原子上有一对孤对电子),能跟具有空轨道的H+形成配位键。而水能电离出少量的H+,因此NH3溶于水时肯定有少量的NH3与水电离出来的H+以配位键结合形成NH4+(绝大部分的NH3是以氢键与水分子结合成NH3·H2O),从而破坏了水的电离平衡,促进了水的电离。
6、一般加热都有利于弱电解质的电离,而为什么氨水受热时却不利于NH3·H2O的电离?
答:弱电解质的电离过程是吸热过程,加热时可使电离平衡正向移动,从而促进了弱电解质的电离。但氨水受热时,NH3·H2O易分解生成NH3逸出,从而抑制了NH3·H2O的电离。
7、为什么在书写离子方程式时不能将NH3·H2O拆开或写成NH4OH的形式?
答:因为NH3·H2O是弱电解质,根据书写离子方程式的要求,难电离的物质应写成化学式,不应拆开。如果把NH3·H2O写成NH4OH的形式就意味着一水和氨应属于离子化合物,这显然是错误的。
8、氨水浓度越大,密度越大吗?
答:一般情况下,密度大于1的溶液,浓度与密度成正比。但对于密度小于1的溶液(如氨水、酒精等)来说,浓度增大,密度却减小。
9、NH3、H2O和OH-结合H+能力的大小如何判断?
答:在铵盐溶液中加入强碱并加热的反应为:NH4++OH- NH3↑+H2O,OH-夺取了NH3结合的H+,所以结合H+的能力为OH->NH3。向酸液中通入NH3的反应为:NH3+H3O+=NH4++H2O,NH3夺取了H3O+中的H+,所以结合H+的能力为NH3>H2O。故结合H+能力大小顺序是OH->NH3>H2O。
10、氨水与碱一定不发生反应吗?
答:不一定,氨水能与AgOH、Cu(OH)2等发生络合反应生成络合物。如,Ag++3NH3·H2O=[Ag(NH3)2]++OH-+NH4++2H2O。
11、NH3中n(呈最低价)-3价,NH3在化学反应中一定只表现还原性吗?
答:不一定,NH3中n(原子虽呈最低价),但H处于高价态,具有氧化性,如,液氨和钠反应生成NaNH2和H2,NH3却表现氧化性。
12、实验室制NH3时,一般用氯化铵与熟石灰混合加热,为什么不用硝铵、硫铵、碳铵来代替氯化铵制取NH3?
答:硝铵加热时会发生爆炸性的分解反应而危险;硫铵与氢氧化钙反应时生成微溶于水的硫酸钙,易使反应混合物结块,使生成的氨气不易逸出;碳铵受热分解放出CO2,使制得的氨气不纯。
13、实验室制NH3时,为什么选用氢氧化钙而不用氢氧化钠?
答:因为氢氧化钠固体易潮解,对玻璃器皿有较强的腐蚀性,易板结。另外,氢氧化钙比氢氧化钠价廉。
14、收集氨气时为什么要在试管口放一团棉花(要用水或稀盐酸浸湿)?
答:减小氨气与空气的对流速度,使收集的氨气较纯,还可防止氨气逸散到空气中污染空气。
15、NH3是碱性气体,能用中性干燥剂无水CaCl2干燥吗?
答:因为CaCl2与NH3易生成CaCl2·8NH3络合物。
16、氯化铵与熟石灰共热反应生成了能与NH3反应的CaCl2和H2O,为什么没将NH3溶解或吸收?
答:加热条件下,不利于CaCl2的氨合反应,且NH3的溶解度也大大降低。
17、用NH3作喷泉实验要注意什么?
答:装置不漏气,烧瓶要干燥,NH3要干燥且充满烧瓶。
18、用蘸有浓盐酸和浓氨水的两根玻璃棒做NH3与HCl反应的实验时,两根玻璃棒为什么只能靠近而不能接触?
答:靠近时,浓氨水挥发出来的NH3和浓盐酸挥发出来的HCl在空气中相遇生成微小的氯化铵晶体,能呈现白烟现象。若两支玻璃棒接触,相当于氨水与盐酸混合反应,尽管也有氯化铵生成,但生成的氯化铵仍溶于两种溶液中,无法观察到白烟现象。
19、保存氨水时为什么不用棕色瓶?
答:因为浓氨水只是挥发而不能误认为是NH3·H2O。对于只是易挥发的物质不必用棕色瓶保存。但对于因见光或受热而分解变质的物质需用棕色瓶保存,如:浓硝酸、硝酸银、卤化银等。
20、为什么在储存和运输氨水时,不能用金属容器?
答:由于受到空气的作用,在金属表面往往都有一层氧化物生成。这些氧化物与氨水作用后,有的能生成稳定的络离子,有的能生成氢氧化物,从而使金属逐渐受到腐蚀。如,把铜片放入较浓的氨水中振荡,会看到溶液变蓝色。
三、NOx有关疑难点分析
1、NO、NO2为什么不是HNO2、HNO3的酸酐?
答:因为酸酐是含氧酸脱水后生成的氧化物(不包括有机酸酐)。其主要特征是酸酐中的成酸元素跟酸酐对应水化物(即含氧酸)中的成酸元素的化合价相同,而NO、NO2中氮元素的化合价与HNO2、HNO3中氮元素的化合价不同,因此,它们不是HNO2和HNO3的酸酐。
2、NO2不能完全溶于氢氧化钠溶液中吗?
答:受反应3NO2+H2O=2HNO3+NO的影响,不少学生会误认为NO2通入氢氧化钠溶液中也有NO产生。事实上,NO2可完全溶于氢氧化钠溶液中:2NO2+2NaOH=NaNO3+NaNO2+H2O,且还有NO2+NO+2NaOH=2NaNO2+H2O。
3、实验室用Cu和稀HNO3制取NO,收集NO时未将NO2完全赶出对NO的纯度有影响吗?
答:没有,因为NO只能用排水发收集,少量的NO2与水反应也产生NO。
4、鉴别NO2与溴蒸气时选择试剂应注意哪些问题?
答:①不能用KI淀粉试纸,因为它们都能将KI氧化为I2,从而使淀粉变蓝。但可用AgNO3溶液。②不用pH试纸,因为两者都能使湿润的pH试纸变红色。但可用浓氨水。③不能用氢氧化钠溶液,因为两者都能与氢氧化钠反应得到无色物质。但可用水。
四、HNO3有关疑难点分析
1、“发烟硝酸”与“发烟硫酸”的“发烟”原理有何区别?
答:“发烟硫酸”是溶解于纯硫酸中的SO3挥发出来和空气中的水蒸气反应生成的硫酸与空气中的水蒸气结合成硫酸小液滴;“发烟硝酸”是挥发出来的HNO3和空气中的水蒸气结合形成了硝酸小液滴。
2、敞口放置的浓硫酸和浓硝酸浓度下降的原因有何区别?
答:浓硫酸浓度的降低是因为浓硫酸具有较强的吸水性,吸水后使溶剂质量增大,而溶质质量不变;浓硝酸浓度的降低是因为浓硝酸具有挥发性,使溶质质量减少,而溶剂质量基本不变。
3、硝酸的挥发性和不稳定性有何区别?
答:挥发性一般是指物质易脱离原来所处的状态成气态逸出,它仍是原来的物质,只是所处的状态发生了变化,属物理变化。如打开浓硝酸瓶塞时,即可看到“酸雾”这是HNO3的挥发性所致。不稳定性一般是指在受热、见光、外力作用或浓度较大等情况下,易发生分解反应生成其他物质,属化学变化。如硝酸在放置过程中会慢慢变黄,这是由于HNO3的不稳定性所致。
4、硝酸只具有氧化性吗?
答:不是,浓硝酸在加热或光照条件下的分解反应中,n(元素既有化合价的升高),又有化合价的降低,故既有氧化性,又有还原性。
5、浓硝酸具有漂白作用吗?
答:滴几滴紫色石蕊试液于浓硝酸中,溶液先变红,后褪色。这一实验现象与紫色石蕊试液滴到新制的氯水中的现象完全相同。这是由于浓硝酸、次氯酸都具有强氧化性,在此,次氯酸的这个作用可称为漂白作用。但通常不说浓硝酸有漂白作用,而说它的强氧化性,这是由于浓硝酸具有强烈的腐蚀性。
6、浓硝酸一定能使Fe、Al“钝化”吗?
答:不一定,浓硝酸有强氧化性,在常温下能使Fe、Al金属表面氧化,形成一层致密的氧化物薄膜而发生“钝化”,但加热条件下或将Fe、Al变成细小的粉末,“钝化”现象就不会发生。
7、硝酸无论浓还是稀,为什么与金属作用一般都不产生H2?
答:在酸性条件下,NO3-的氧化性远强于H+,故硝酸在与金属反应时,NO3-首先夺得电子生成氮的氧化物、氮气或铵盐,只有当硝酸很稀时,与某些金属(如Mg、Zn)反应才会产生一定量的H2。
8、硝酸与金属反应时,硝酸只能被还原为氮的氧化物吗?
答:不是,一般情况下,金属与硝酸反应,硝酸被还原为NO2和NO,但锌与极稀的硝酸反应时,硝酸被还原为NH4NO3。
9、一定量的浓硝酸与足量的铜粉反应,硝酸只能被还原为NO2吗?
答:不是,随着反应的进行,硝酸不断消耗,其浓度逐渐降低,最后成为稀硝酸,此时若有铜存在,硝酸将会被还原为NO。
10、硝酸与铜反应时,浓硝酸被还原为NO2,稀硝酸被还原为NO,这能否说明稀硝酸的氧化性比浓硝酸强?
答:不能,因为硝酸的氧化性强弱不是由其还原产物中氮元素的化合价改变多少来决定的,而是由硝酸的浓度决定的,硝酸的浓度越大,其氧化性越强。如稀硝酸只能将氢碘酸氧化成I2,而浓硝酸却能将氢碘酸氧化成碘酸。
11、硝酸与非金属单质反应有何规律?
答:非金属单质在加热条件下,可被硝酸氧化成氧化物或含氧酸。还原产物若是浓硝酸被还原为NO2,若是稀硝酸被还原为NO。
12、如何判断在反应中,硝酸只显酸性,只显氧化性,或既显氧化性又显酸性?
答:这要看生成物中氮元素化合价。如果生成物中只有+5价的N,则硝酸只显酸性;生成物中无+5价的N,只显氧化性;生成物中既有+5价的N,又有低于+5价的N,则既显氧化性又显酸性。
13、某溶液先用稀硝酸酸化,再加入BaCl2溶液,有白色沉淀生成,能说明原溶液中一定有SO42-吗?
答:不一定,若原溶液中含有SO32-,加入的硝酸会把SO32-氧化为SO42-,从而也会产生白色沉淀。若原溶液中含有Ag+,会与加入的BaCl2溶液中的Cl-反应产生白色沉淀。
14、久置的浓硝酸为什么显黄色?
答:是因为硝酸分解产生的NO2溶于硝酸。黄色是少量NO2本身的颜色,此处符合“相似相溶”规律,NO2是极性分子溶质,硝酸是极性分子溶剂。
15、硝酸如何保存?
答:由于硝酸见光易分解,且有腐蚀性,故应保存在棕色瓶中,且放于冷暗处,还要用磨口玻璃塞而不能用橡胶塞。
16、如何检验NO3-?
答:将稀溶液浓缩后加铜和浓硫酸共热,出现红棕色气体,即证明原溶液中含有NO3-。
五、磷及其化合物有关疑难点分析
1、氮族元素单质的熔沸点随着核电荷数的增大而升高吗?
答:不是,随着核电荷数的增大其单质的晶体类型不同:氮、磷、砷三者属于分子晶体,其单质的熔沸点随着核电荷数的增大而升高;锑和铋是金属晶体,其单质的熔沸点随着核电荷数的增大而降低。
2、氮、磷能形成简单的N3-和P3-吗?
答:在氮族元素中仅仅电负性较大的氮和磷可以形成极少数化合价为-3价的离子型固态化合物(如Li3N、Na3N、Mg3N2、Ca3P2等)。由于N3-和P3-有较大的半径,容易变形,遇水强烈水解生成NH3、PH3。因此这种离子化合物只能存在于干态,溶液中不存在N3-和P3-的简单水合离子。
3、久置的红磷上方为什么有一层液体?
答:久置红磷上方的液体是磷酸和偏磷酸的混合酸溶液。红磷与空气长期接触会发生缓慢氧化,形成易吸水的氧化物,吸水后形成磷酸或偏磷酸的溶液。
4、红磷和白磷的相互转化是物理变化还是化学变化?怎样判断白磷和红磷是磷的同素异形体?
答:白磷为正四面体结构,红磷的结构更复杂,它们的转化是发生了化学键的转化,所以红磷和白磷的相互转化是化学变化。
要判断白磷和红磷是磷的同素异形体,即要证明它们都是由同一种元素构成。可采用在氧气中燃烧,都生成P2O5,即与同一种物质反应,生成物相同。
5、做红磷与白磷的转化实验时,看到的是黄色的蒸气,为什么教材上却称作白磷?
答:纯白磷是无色透明的晶体,遇光即逐渐变为黄色。
6、白磷有剧毒,误食1g 就能致死,皮肤若不小心沾上白磷,应如何处置?
答:如不慎把白磷沾到皮肤上,可用硫酸铜溶液冲洗,利用磷的还原性来解毒,2P+5CuSO4(冷)+8H2O=5Cu+2H3PO4+5H2SO4。
7、P2O5溶于水中只生成H3PO4吗?
答:不是。一般同种物质与冷水或热水分别反应时,只是反应快慢不同,生成物的种类相同,但P2O5却与冷水反应生成偏磷酸(HPO3),而与热水反应生成磷酸(H3PO4)。
8、磷酸是中强酸,磷酸与强碱反应生成的盐溶液都显碱性吗?
答:不是,磷酸与氢氧化钠反应能生成NaH2PO4,其中H2PO4-在水中电离出H+的能力强于H2PO4-的水解(产生OH-)能力,故溶液显酸性。
9、磷的含氧酸有多种形式,如磷酸(H3PO4)、亚磷酸(H3PO3)、次磷酸(H3PO2)等,上述三种酸的化学式中都有三个氢原子,它们都是三元酸吗?
答:不是,对于磷的含氧酸来说,判断含氧酸的元数不是看化学式中的氢原子个数,而是看与中心原子相连-OH的数目。因为只有与中心原子相连的-OH中的氢才会电离,而与中心原子直接相连的氢则不能电离。上述三种酸的结构分别为:
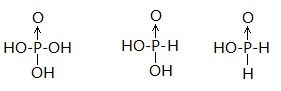
从上可以看出,磷酸为三元酸,亚磷酸为二元酸,次磷酸是一元酸。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
1.硫代硫酸钠(Na 2 S 2 O 3 ): Na 2 S 2 O 3 ·5H 2 O俗名海波或大苏打,...
...
磷作为周期表第 ⅤA 族核心元素,兼具 “生命不可替代性”(构...
硫酸盐 俗名 颜色 用途 2CaSO 4 H 2 O 熟石膏 白色 CaSO 4 2H 2 O 生石膏...
...
1.在二元化合物中,如果电正性的金属元素仅出现两种氧化态时...