
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
元素周期律从宏观的角度揭示了元素及其化合物间的相互联系和性质变化规律,它是元素周期表的高度概括;而元素周期表具体地展现了元素及化合物性质的变化情况(周期性、相似性和递变性),它是元素周期律的具体体现。元素的原子结构、元素性质、元素周期律和周期表间有如下关系:
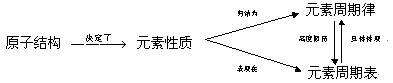
1、元素及其化合物的性质与元素周期表位置的关系
在元素周期表中,主要研究以下性质:即元素的原子半径和离子半径,主要化合价(指最高正价和负价),元素及所形成单质的金属性和非金属性、还原性和氧化性;元素最高价氧化物的水化物的酸碱性;气态氢化物的形成难易、稳定性和还原性,以及其水溶液的酸性(指ⅥA、ⅦA族)。这些性质在表中存在着纵、横两个十分重要的递变规律。(注意,下面叙述一般不涉及零族元素)
① 同一周期中,元素及其化合物的性质递变规律
在同一周期中,从左到右,随着原子序数的递增
Ⅰ.原子半径、阳离子半径、阴离子(单核)半径逐渐减小。
由于原子半径大小决定于电子层数(n)和核电荷数(Z)的大小,即r=|(n·Z),所以
对同种元素,r阳离子<r原子,r原子<r阴离子;
阴离子的电子层结构与同周期零族元素原子的电子层结构相同,阳离子的电子层结构则与上一周期零族元素原子的电子层结构相同。
电子层结构相同的离子(单核,与稀有气体原子的电子层结构相同,故叫稀型离子),其离子半径随离子电荷数(或核电荷数)的增大而减小,如:Ne型离子的半径(10-10 m):
F- Na+ Mg2+ Al3+
1.33 0.97 0.65 0.50
Ⅱ.元素的金属性逐渐减弱,非金属性逐渐增强。在表中,最活泼的金属是Fr,天然存在的最活泼的金属是铯;最活泼的非金属元素是F。
Ⅲ.元素所形成的单质的还原性逐渐减弱,氧化性逐渐增强。
Ⅳ.元素最高氧化物对应的水化物的碱性逐渐减弱,酸性逐渐增强。
Ⅴ.非金属元素的气态氢化物的形成逐渐容易,稳定性逐渐增强。(特例:第二周期中(CH4的稳定性强于NH3))。
Ⅵ.无氧酸的酸性逐渐增强。
Ⅶ.非金属元素负价态的还原性逐渐减弱。
Ⅷ.元素的最高正价从+1价递增至+7价,负价从 -4价(ⅣA族)递增至 -1价。
注意:金属元素无负价;ⅣA、VA族气态氢化物分子式的写法与ⅥA、ⅦA族不一样。
② 同一主族中,从上到下,随着原子序数的增加
Ⅰ.原子半径、阳离子半径、阴离子(单核)半径逐渐增大。
Ⅱ.元素金属性逐渐增强,非金属性逐渐减弱。左边为活泼的金属族,右边为活泼的非金属族;中间的第ⅥA、VA族则是从非金属元素过渡到金属元素的完整的族,它们的同族相似性甚少,而具有十分明显的递变性。
Ⅲ.元素的最高氧化物对应水化物的碱性逐渐增强,酸性逐渐减弱。因而表中最强的碱是FrOH,天然存在的最强碱是CsOH;最强的酸是HClO4。
Ⅳ.元素所形成的单质的还原性逐渐增强,氧化性逐渐减弱。
Ⅴ.非金属元素的气态氢化物的形成逐渐困难,稳定性逐渐减弱。
Ⅵ.非金属元素所形成的无氧酸的酸性逐渐增强。这一点要特别注意。如最活泼的非金属元素氟形成的氢氟酸却是弱酸,而HC1、HBr、HI则是强酸,且酸强度依次增强。
Ⅶ.非金属元素负价态的还原性逐渐增强。
Ⅷ.同族元素其最高正价相同,它等于元素所在的族序数,而非金属元素的负价也相同,它等于族序数减8。大多数非金属元素具有变价,其规律是正价的相邻价差为2。如ⅦA族为十7、+5、+3、+1、一1(氟例外,无正价),VA族为+5、+3、+1、一3(氮很特殊,从+l到+5价皆有)。
③ 元素周期表中的性质分区。以铝跟硅、钋跟砹之间划一斜线,左下面是一大片金属元素,右上角是非金属元素。
2、原子结构与元素周期表位置的关系
① 核内质子数一核外电子数=核电荷数=原子序数=Z
② 元素所在周期序数等于原子的电子层数。元素所在的主族序数等于原子最外层的电子数。因此,由元素原子的电子层数和最外层电子数可确定元素在周期表中的位置,确定是什么元素。
③ 同一周期元素原子的电子层数相同,同一主族元素原子的最外层电子数相同。
3、元素周期表中元素性质与原子结构的关系
除在原子结构中讨论的关系外,在表中还存在如下关系:
① 主族元素最高正价等于其原子的最外层电子数(即价电子).非金属元素的负价等于其原子的最外层电子数一8。非金属元素的最高正价与负价绝对值的和为8.故知其气态氢化物通式时,即可确定其最高正价,写出其最高正价氧化物的通式;反之亦然。
② 同一主族元素化学性质相似是由于原子的最外层电子数相同;性质的递变性是由于随着原子序数的增加,电子层数依次增加一层。半径增大。使原子失电子容易,得电子困难所致,同一周期性质的递变性原因是,仅管原子的电子层数相同;但随着核电荷数的增加.最外层电子数依次增加1个,原子半径逐渐减小,使原子失电子困难,得电子容易所致。
③ 同一周期中,从左到右,主族元素原子半径减小;是因为随核电菏数的增加.虽然最外层电子数在增加,但核电荷数增加的影响远大于电子数增加的影响。同一主族,从上到下原子半径逐渐增大,是因为电子层数增加的影响起主要作用。
总之,元素及其化合物性质的周期性变化是由于原子核外最外层电子由1到8的周期性变化所引起的。
元素周期系统,不仅是元素分类的客观规律的揭示,使元素性质井然有序,便于掌握。更为重要的是通过元素周期律可以推断、预言新的未知元素,并有力地促进物质结构理论的发展。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
本文将给出基于八隅律的电子式的书写步骤。与以往教学不同之...
氯离子(Cl)的半径大于铯离子(Cs)!!!课本上没有错哦!...
含氧酸是酸中的主角,常见的含氧酸中,有高某酸、正某酸、亚...
一、常见三种原子半径的标准 首先我们说说原子半径有几种不同...
【导读】键长和键能的关系在化学中通常表现为反比规律:键长...
...