
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在高中化学教学中,缓冲溶液是一个重要概念。它不仅体现了酸碱平衡的动态特性,还广泛应用于生物、医学、环境和工业等多个领域。
一、什么是缓冲溶液?
缓冲溶液是指由弱酸与其共轭碱(如 HAc 与 NaAc)或弱碱与其共轭酸(如 NH₃·H₂O 与 NH₄Cl)组成的混合溶液,能够在加入少量强酸、强碱或被适当稀释时,保持其 pH 值基本不变。这种抵抗外界干扰、维持体系 pH 稳定的能力,称为缓冲作用。
二、实验揭示缓冲能力
实验:分别取纯水、0.1 mol·L⁻¹ KCl 溶液以及等浓度(0.1 mol·L⁻¹)的 HAc-NaAc 混合溶液各 90 mL,进行以下操作并记录 pH 变化:
实验操作 | 纯水 | KCl 溶液 | HAc-NaAc |
|---|---|---|---|
初始状态 | 7.0 | 7.0 | 4.75 |
加 10 mL 0.01 M HCl | 3.0 | 3.0 | 4.74 |
加 10 mL 0.01 M NaOH | 11.0 | 11.0 | 4.76 |
加 10 mL 水稀释 | 7.0 | 7.0 | 4.75 |
从数据可见:
纯水和 KCl 溶液无缓冲能力,在加入微量酸或碱后,pH 发生剧烈变化;
HAc-NaAc 混合液的 pH 几乎不变,即使稀释也保持稳定。
这说明只有含有共轭酸碱对的体系才具备缓冲能力。
三、缓冲作用的原理
以 HAc-NaAc 体系为例,其缓冲机制基于以下两个平衡:
1. 醋酸的电离平衡:
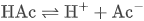
2. 醋酸钠完全电离:
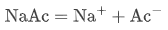
因此,溶液中同时存在较高浓度的 HAc(弱酸) 和 Ac⁻(其共轭碱)。
当加入少量强酸(如 HCl):外来的 H⁺ 会与 Ac⁻ 结合生成 HAc,消耗 H⁺,抑制 pH 下降:
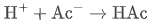
当加入少量强碱(如 NaOH):OH⁻ 与 H⁺ 结合成水,促使 HAc 进一步电离补充 H⁺,抑制 pH 上升:
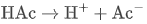
稀释时:虽然 [HAc] 和 [Ac⁻] 同比例降低,但它们的比值 [HAc] / [Ac⁻]不变。根据 Henderson-Hasselbalch 方程:
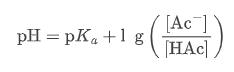
只要比值不变,pH 就几乎不变。
四、哪些溶液具有缓冲能力?
根据上述分析,具备缓冲作用的溶液需满足以下条件:
含有浓度较高的弱酸及其共轭碱,或弱碱及其共轭酸;
两者浓度相近,通常在 0.05–0.5 mol·L⁻¹ 范围内效果最佳;
pH 接近该弱酸(或弱碱)的 pKa(或 pKb)。
中学阶段常见的缓冲体系包括:
弱酸型:HAc / NaAc(pH ≈ 4.75)
弱碱型:NH₃·H₂O / NH₄Cl(pH ≈ 9.25)
五、缓冲溶液的实际意义
缓冲溶液不仅是理论教学的重点,更在现实中不可或缺:
生物体内:血液中的 H₂CO₃/HCO₃⁻ 缓冲对维持 pH 在 7.35–7.45;
实验室:配制标准缓冲液用于 pH 计校准;
工业生产:发酵、染料、制药等过程需严格控制 pH;
环境保护:湖泊、土壤的缓冲能力影响生态系统稳定性。
通过实验观察与理论分析,我们认识到缓冲溶液并非“不变化”,而是在动态平衡中巧妙地“自我调节”。它体现了化学平衡的智慧——在扰动中寻求稳定。理解缓冲溶液,不仅有助于掌握酸碱理论,更能培养科学思维:面对变化,系统如何通过内在机制维持秩序。这正是化学之美,也是教育之要义。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
水溶液中NH水解显酸性,CO、HCO水解显碱性,二者会发生“相互促...
在基础化学中,我们常被告知:盐类水解通常是微弱且可逆的。...
一般来说,溶解度大的物质易转化为溶解度小的物质。那反过来...
一.定义 1.pH pH=–log[H] pH是衡量溶液整体酸碱度的指标,具体指溶...
溶解度(Solubility)与溶度积常数(Solubility Product Constant, ksp密切...
【导读】与第一电离能定义相反(并非严格互逆过程),第一电子...