
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、电解质、非电解质
01.电解质:在水溶液或熔融状态下能够导电的化合物。
02.非电解质:在水溶液和熔融状态下都不能导电的化合物。
03.电解质、非电解质的研究对象是化合物。单质和混合物既不是电解质也不是非电解质。
04.酸、碱、盐、水、绝大多数金属氧化物是电解质,如HCl、NaOH、NaCl等。
05.非金属氧化物、大多数氢化物、绝大多数有机物(例如CO2、NH3、蔗糖等)都是非电解质。
06.电解质不一定能导电,导电需要条件,如固态的NaCl就不导电。
07.能导电的物质不一定是电解质,如NH3溶于水,能够导电,其导电原因是NH3与水反应生成的NH3·H2O产生的离子NH4+、OH-导电。
08.不导电的物质不一定不是电解质(例如难溶性盐水溶液,导电性很弱,难溶性盐是电解质)
09.强电解质:在水溶液或熔融状态下能全部电离的电解质。
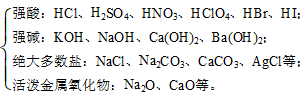
10.弱电解质:在水溶液或熔融状态下部分电离的电解质。
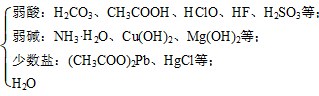
11.电解质的强弱与溶解性无关,如易的溶醋酸是弱电解质,难溶的BaSO4为强电解质。
12.电解质溶液的导电能力取决于溶液中的离子浓度和离子所带电荷。
离子浓度一定,离子所带电荷越多,导电性越强;离子所带电荷一定,浓度越大,导电性越强。
13.电解质溶液的导电能力与电解质的强弱无必然联系。
14.电离:电解质溶于水或受热融化时,形成自由移动的离子的过程。
15.强电解质电离方程式:用=连接: NaCl=Na++Cl-
16.弱电解质电离方程式:用 连接:CH3COOH
连接:CH3COOH CH3COO-+H+
CH3COO-+H+
17.酸式盐的电离方程式:酸式盐均为强电解质,电离用=连接。
18.酸式盐只有NaHSO4的盐在水溶液中电离成三部分,NaHSO4=Na++ H++ SO42-;
其余情形全部只电离成两部分,如NaHCO3=Na++ HCO3-;NaHSO4(熔融)=Na++ HSO4-。
二、离子方程式
01.电解质在溶液中的反应实质上是离子之间的反应。
02.复分解型离子反应发生的条件有三个:生成难溶物、生成气体、生成水。
生成难溶物:Mg(OH)2、Al(OH)3、Fe(OH)3、Cu(OH)2、AgCl、BaSO4、CaCO3、BaCO3、Ag2CO3;
生成气体:CO2、SO2、NH3;
03.复分解型离子反应发生的条件在高中可以认为两大类:生成难溶物、生成弱电解质。
常见弱电解质:弱酸H2CO3、H2SiO3、H2S、CH3COOH、HF、HClO;弱碱:NH3·H2O;水
04.用实际参加反应的离子符号来表示反应的式子叫离子方程式。
05.离子方程式的书写可以按“写、拆、删、查”四步来完成:
一写:写出反应的化学方程式。
二拆:把强酸、强碱和大部分可溶性盐写成离子形式。
三删:删去方程式两边不参加反应的离子,并将方程式化为最简。
四查:检查离子方程式两边各元素的原子个数和电荷总数是否相等。
06.离子方程式不仅可以表示某个具体的化学反应,还可以表示同一类型的离子反应。
07.同一溶液中,若离子间符合下列任意一个条件就会发生离子反应,离子间便不能在大量共存。
(1)生成难溶物或微溶物。如Ba2+与CO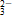 ,Ag+与Cl-,Ba2+与SO
,Ag+与Cl-,Ba2+与SO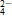 、Ca2+与OH-等。
、Ca2+与OH-等。
(2)生成 气体或挥发性物质。如NH
气体或挥发性物质。如NH 与OH-、H+与CO
与OH-、H+与CO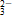 、HCO
、HCO 等。
等。
(3)生成弱电解质。
如H+与CH3COO-、CO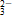 、HCO
、HCO 、S2-、HS-、SO
、S2-、HS-、SO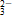 、HSO
、HSO 等生成弱酸;
等生成弱酸;
OH-与NH 生成弱碱;
生成弱碱;
H+与OH-生成水。
(4)能发生氧化还原反应:Fe2+与HNO3。
08.特殊条件下离子的共存问题
(1)溶液无色透明时,则溶液中一定没有有颜色的离子,如Fe3+(黄)、Fe2+(绿)、Cu2+(蓝)、MnO4-(紫)、Cr2O72-(橙)、CrO4-(黄)、Cr2+(绿)等。
(2)能与Al反应产生H2的溶液中,既可能存在大量的H+,也可能存在大量的OH-。
(3)HCO3- 、HSO3-等多元弱酸的酸式酸根离子不能与H+、OH- 大量共存。
09.在酸性溶液中,不能共存的离子有:
S2-、HS-、CO32-、HCO3-、SO32-、HsO3-、S2O32-、AlO2-、SiO32-、F-、ClO-、CH3COO-、OH-等。
10.在碱性溶液中,不能共存的离子有:Ag2+、Fe2+、Fe3+、Al3+、Cu2+、NH4+等。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一、电解质、非电解质 01.电解质:在水溶液或熔融状态下能够...
...
...
...
...
溶液中的离子共存问题是高考的热点问题,也是高考化学复习的...