
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
【问题】
室温时,下列溶液等体积混合后,溶液pH是大于7、小于7、等于7、还是无法判断?
①0.1 mol·L-1的盐酸溶液和pH=13的氢氧化钡溶液
②0.1 mol·L-1的硫酸溶液和pH=13的氢氧化钠溶液
③pH=1的盐酸溶液和0.1 mol·L-1的氨水溶液
④pH=1的硫酸和0.1 mol·L-1某一元碱溶液{溶液中[OH-]∶[H+]=1×108}
⑤pH=3的醋酸溶液和0.001 mol·L-1的氢氧化钠溶液
⑥pH=3的盐酸溶液和pH=11的氨水溶液
⑦pH=3的硫酸溶液和pH=11的氢氧化钠溶液
⑧pH=3的某酸溶液和pH=11的氢氧化钠溶液
⑨pH=3的盐酸溶液和pH=11的某碱溶液
⑩pH=3的某酸溶液和pH=11的某碱溶液
【解析】
①pH=13的Ba(OH)2溶液中的[OH-]=0.1mol·L-1,与0.1mol·L-1的盐酸恰好完全中和,pH=7。
②0.1mol·L-1的H2SO4溶液中的[H+]=0.2mol·L-1,与pH=13的氢氧化钠溶液中和反应,H2SO4过量,pH﹤7。
③pH=1的盐酸和0.1mol·L-1的氨水溶液恰好完全中和,生成NH4Cl强酸弱碱盐水解呈酸性,pH﹤7。
④0.1mol·L-1某一元碱的[OH-]=1×108×[H+]=108×10-14(mol·L-1)2/[OH-] ,[OH-] =10-3mol·L-1,故该一元碱是弱碱,一元弱碱溶液与硫酸恰好反应生成的强酸弱碱盐水解呈酸性,pH﹤7。
⑤pH=3的醋酸浓度远大于0.001mol·L-1,二者反应时醋酸过量,虽生成的盐水解呈碱性,但CH3COOH的电离程度大于CH3COONa的水解程度,pH﹤7。
⑥pH=11的氨水浓度远大于10-3mol·L-1,二者反应时氨水过量,虽生成的盐水解呈酸性,但氨水的电离程度大于NH4Cl的水解程度,pH﹥7。
⑦pH=3的硫酸和pH=11的氢氧化钠溶液恰好完全中和,pH=7。
⑧pH=3的某酸,可能是强酸,也可能是弱酸,若强酸与pH=11的氢氧化钠溶液恰好完全中和,pH=7;若弱酸与pH=11的氢氧化钠溶液中和时,弱酸过量, pH﹤7。故混合后溶液pH≤7。
⑨pH=11的某碱溶液,可能是强碱,也可能是弱碱,若强碱与pH=3的盐酸溶液恰好完全中和,pH=7;若弱碱与pH=3的盐酸溶液中和时,弱碱过量,pH﹥7。故混合后溶液pH≥7。
⑩某酸与某碱的强弱情况均未知,故混合后溶液的酸碱性无法判断。
【感悟】
①酸碱混合溶液pH的定性判断主要决定于[H+]与[OH-]的相对大小。
②提供酸碱的量不同直接影响混合后溶液的pH。酸与碱混合时发生中和反应,不一定恰好完全中和。即使恰好完全中和,溶液也不一定呈中性,由生成的盐能否水解及水解情况而定。
③当已知强酸或强碱溶液的pH时,c(H+)或c(OH-)与酸或碱的几元性无关;当已知强酸或强碱溶液的物质的量浓度时,c(H+)或c(OH-)则与酸或碱的几元性有关。
④当已知弱酸或弱碱溶液的pH时,由于弱酸或弱碱电离不完全,存在电离平衡,其物质的量浓度远大于c(H+)或c(OH-),溶液的pH由过量的弱酸或弱碱决定。
【巩固】
例1.(上海)常温下a mol·L-1CH3COOH稀溶液和 b mol·L-1KOH稀溶液等体积混合,下列判断一定错误的是()
A.若c(OH-)﹥c(H+),a = b
B.若c(K+)﹥c(CH3COO-),a﹥b
C.若c(OH-)=c(H+),a﹥b
D.若c(K+)﹤c(CH3COO-),a﹤b
【解析】当a=b时,二者恰好反应生成强碱弱酸盐CH3COOK水解呈碱性,A项正确;当 a>b时,反应后溶液中溶质为CH3COOK和CH3COOH,该溶液可能呈中性,则C项正确;若该溶液含CH3COOH很少,CH3COOH电离出的c(H+)小于CH3COO-水解生成的c(OH-),溶液呈碱性,由电荷守恒知c(K+)﹥c(CH3COO-),B项正确;当a﹤b时,溶液一定呈碱性,则一定有c(K+)﹥c(CH3COO-),与c(K+)﹤c(CH3COO-)矛盾,D项一定错误。
例2.(海南)25℃时,a mol·L-1一元酸HA与 b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是( )
A.a = b B.a﹥b C.c (A-) = c(Na+) D.c (A-)﹤c(Na+)
【解析】酸碱中和后pH为7,溶液显中性,若HA为强酸,则a = b;若HA为弱酸,则a﹥b。但不知是强酸还是弱酸,故无法确定a和b的关系,A、B项不一定正确。由电荷守恒与c(H+)=c(OH-)知,c(Na+)=c(A-),C项一定正确,D项错误。
【体验】
练1.(四川)常温下,下列溶液中的微粒浓度关系正确的是( )
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)﹥c(HCO3-)﹥c(CO32-)﹥c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)﹥c(OH-)=c(H+)
D.0.2mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
【提示】D项的恒等式可由电荷守恒与物料守恒推出。
练2.(全国)已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判断溶液呈中性的依据是( )
A.a = b
B.混合溶液的pH=7
C.混合溶液中,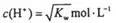
D.混合溶液中,c(H+)+c(B+) =c(OH-)+c(A-)
【提示】因温度T不一定指常温25℃,故pH =7的溶液不一定成中性。
练3.(广东)对于常温下pH为2的盐酸,叙述正确的是( )
A.c(H+)=c(Cl-)+c(OH-)
B.与等体积pH=12的氨水混合后所得溶液显酸性
C.由H2O电离出的c(H+)=1.0×10-12mol·L-1
D.与等体积0.01mol·L-1乙酸钠溶液混合后所得溶液中:c(Cl-)=c(CH3COO-)
练4.(浙江)下列说法正确的是( )
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH﹥7,则H2A是弱酸;若pH﹤7,则H2A是强酸
C.用0.2000mol·L-1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol·L-1),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1mol·L-1氯化镁溶液、④0.1mol·L-1硝酸银溶液中,Ag+浓度:①﹥④=②﹥③
练5.(天津)下列电解质溶液的有关叙述正确的是 ( )
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C.含1 molKOH的溶液与1 molCO2完全反应后,溶液中c(K+)=c(HCO3-)
D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
【参考答案】 1. D 2. C 3. C 4. C 5. D

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
双指示剂法是一种利用两种具有不同变色范围的酸碱指示剂,在...
弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常...
...