
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、考查内容:
1、化学反应与能量
(1)热化学方程式的书写。
(2)利用断成键理论计算ΔH。
(3)利用盖斯定律计算ΔH或书写热化学方程式。
(4)利用活化能理论解释化学反应的能量变化及催化剂对活化能的影响。
2、反应速率
(1)计算化学反应速率。
v=Δc/ΔT
也有用单位时间内物质的量的变化、体积的变化、压强的变化表示反应速率。注意这些表达方式的缺点是若没有空间的限制,并不能准确表达出反应的快慢。
三段法计算:浓度、转化率、产率、体积分数、平均相对分子质量、分压、K等。
(2)化学反应速率的影响因素。
①催化剂:一般会加快反应速率。通过降低活化能来实现。
②温度:升温加快反应速率。
注意:若催化剂与温度一起作用于化学反应时,催化剂对主要起速率起影响作用,温度对催化剂的活性起影响作用。不要回答出温度也能提高反应速率。
③浓度:注意的是,提高反应物的浓度,会提高反应速率。
容易混淆的是,可逆反应的正反应速率和总反应速率,要分清。
④压强:增大压强,必须提高了反应物的浓度,反应速率才会提高。
⑤表面积:反应物的表面积增大,会使反应速率加快。在工业流程中经常考查。
⑥活化能:反应的活化能越高,反应速率越慢。
3、化学平衡
(1)对化学平衡状态的理解:
可逆反应达到最大限度的一种状态,表面上浓度不变,实际上正逆反应都在进行的一定相对稳定状态。
(2)平衡的标志:
反应过程中变化的现象或数据,不变了,达到平衡了。
注意分析是的恒压体系还是恒容体系。
(3)平衡移动:
勒夏特列原理的熟练运用。
(4)平衡常数:
表达式的书写。Kc、Kp的计算。比较Qc与K来判断反应的进行方向。
分压计算时:
恒定体积的容器中:每mol气体的分压是定值。
恒定压强的容器中:每mol气体的分压与体积成反比。
(5)等效平衡:
两个相似体系的比较或一个体系在两个环境下的比较。
等效平衡的应用:充气问题。
4、反应方向(自发性)
ΔG=ΔH-T•ΔS<0,反应能自发进行,分为肯定自发、高温自发、低温自发、肯定不自发。
注意,分析是的反应自动发生的可能性,不是反应在任何条件都不能发生。
二、基本题型:
1、利用盖斯定律计算反应热
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(1) ΔH=-890.3kJ·mol-1
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(1) ΔH=-1299.6kJ·mol-1
2H2(g)+O2(g)=2 H2O(1) ΔH=-571.6kJ·mol-1
则2CH4(g)=C2H2(g)+3H2(g)的 ΔH= kJ·mol-1(答案:+376.4)
2、关于活化能的理解
科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(III)表面发生解离反应时四个路径与相对能量关系如图所示,其中附在Pd(III)表面的物种用×标注。
此历程中活化能最小的反应方程式为。
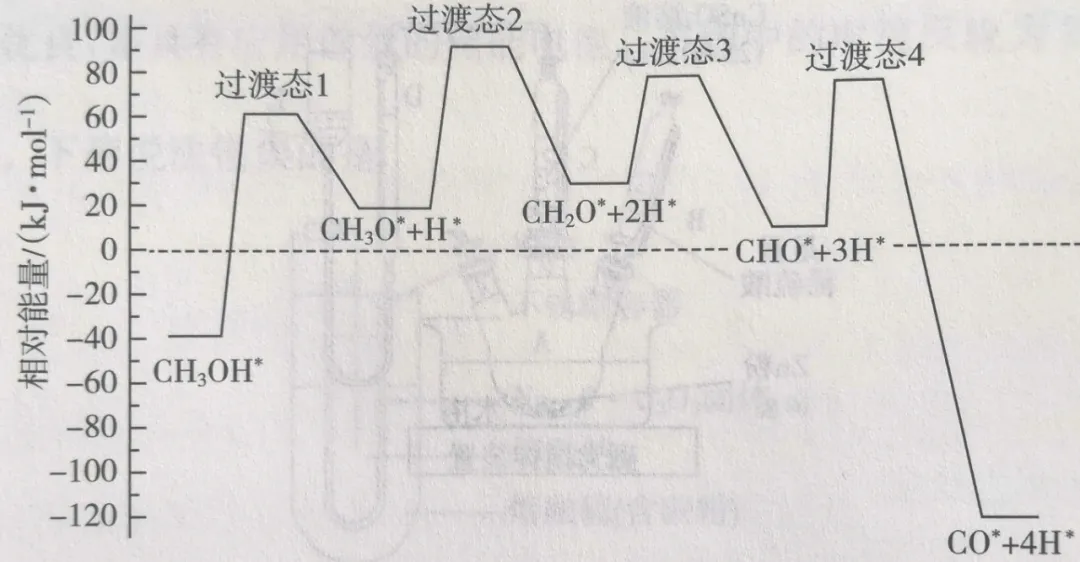
答案:CH2O+2H×=CHO×+3H×或CH2O×=CHO×+H×。
分析:
每一个过渡态的左边为反应物,右边为生成物。左边到过渡态的能量变化为活化能。活化能越高,该反应的反应速率越慢。
本题中活化能最小的是过渡态3,左边为反应物CH2O×+2H×,右边为生成物CHO×+3H×。
3、温度催化剂共同作用于反应速率
CO+H2O⇌CO2+H2 ΔH<0
在0.1 MPa下,将总进料量1 mol 且n(CO):n(H2O)=1:1.3的混合气体充入一刚性密闭容器中,在催化剂的作用下反应。实验测得在600-700℃时,反应速率随温度的升高明显下降,原因是。
答案:温度升高,催化剂的活性降低,反应速率减慢。
分析:当温度和催化剂共同作用于反应速率时,反应速率主要由催化剂决定。温度的升高或降低对反应速率的影响不大,但对催化剂的活性影响很大,而催化剂的活性对反应速率影响很大。
4、反应速率影响因素、平衡移动、平衡常数与温度和ΔH的关系
如图表示反应N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.2kJ•mol-1在t0-t6时间段内反应速率的变化图,已知在t1、t3、t4时改变外界条件,每次外界条件的改变都是单一条件的改变。
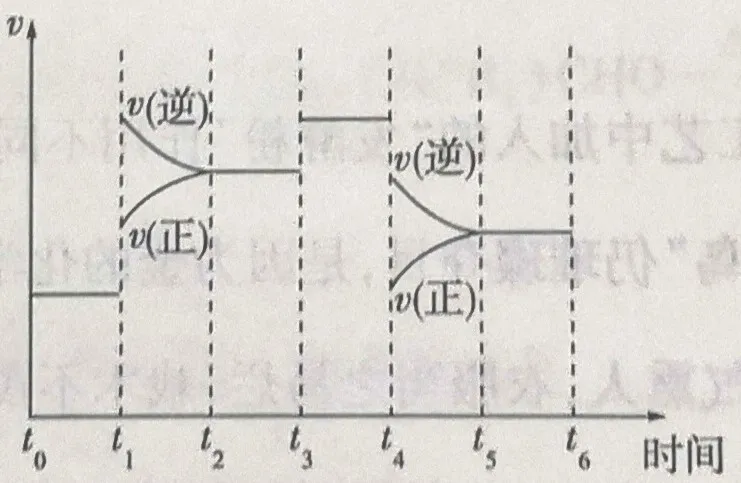
下列有关说法正确的是
A.t1时改变的条件是压缩反应容器
B.t3时改变条件后反应的正活化能和ΔH均下降
C.平衡常数K(t0-t1)>k(t2-t3)>k(t5-t6)
D.氨气的体积分数φ(t2-t3)> φ(t3-t4)>φ(t5-t6)
答案:D
分析:经过分析,t1为升温,t3加催化剂,t4为降压。
B中ΔH不变。
C、放热反应升温后K减小,其它条件不改变平衡常数,所以平衡常数K(t0-t1)>K(t2-t3)=K(t5-t6)。
D、逆向移动,NH3的物质的量减小,体积分数减小。
5、反应物的比例对反应物转化率的影响
若将CO和NO按不同比例投入一密闭容器中发生反应:2NO(g) +2CO( g)⇌N2(g)+2CO2(g) ΔH<0,不同温度下,平衡时N2的体积分数随n(CO)/n(NO)的变化曲线如图所示。
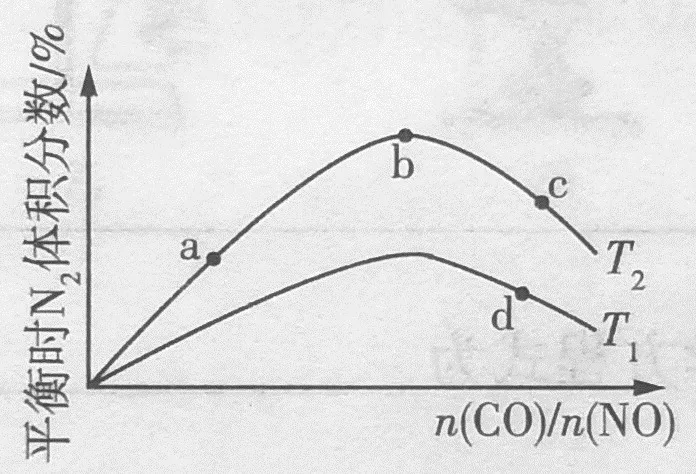
(1)A、B、C三点中对应NO转化率最大的是 。
(2)C、D点对应平衡常数C点(填“>”“<”或“=”)D点,理由是 。
答案:(1)C,(2)>,因为ΔH<0,T1下生成物N2的量较少,所以T1温度高于T2,升温时K减小。
分析:(1)调整两反应物的比例判断转化率时,谁的比例越小,谁的转化率越高。(2)放热反应升温时,平衡逆向移动,平衡常数减小。
6、三段法计算转化率
T1℃时,向1L 恒容密闭容器中充入0.3mol CH4,只发生反应2CH4(g)⇌C2H4(g) +2H2(g)。
(1)达到平衡时,测得c(C2H4)=C(CH4)。CH4的平衡转化率为 。
(2)反应达到平衡状态时,若改变温度至T2℃,CH4的浓度以0.01mol•L-1•S-1的平均速率增多,经 t S后再次达到平衡,此时c(CH4)=2c(C2H4),则t= 。
答案:(1)66·7%,(2)5。
分析:
(1)2CH4(g)⇌C2H4(g) +2H2(g)
0.3 0
-2x +x
0.3-2x x
0.3-2x = x
解得:x=0.1
转化率=0.2/0.3=66.7%
(2)2CH4(g)⇌C2H4(g) +2H2(g)
0.1 0.1 0.1
+2y -y
0.1+2y 0·1-y
0.1+2y = 2(0.1-y)
解得:y=0.025
CH4增加0.05mol/L,时间需要5s。
7、等效平衡
297K时,存在CH3OH(g)⇌CO+2H2,在密闭容器I(体积为4L)和密闭容器II(体积为8L)中分别充入下列物质发生反应(单位为mol)
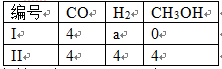
达到平衡时两个容器中c(H2)相等且为0.5mol/L。则a= 。
答案:6。
分析:
I、II若达到平衡时c(H2)相等,则两体系为等效平衡。两体系的体积是两倍关系,则物质的量为等效于两倍关系。
II体系的物质的量相当于CO为8mol,H2为12mol。则I体系中的物质的量CO为4mol,H2为6mol。
8、反应自发性的判断
ScR催化法是工业上消除NO的常用方法,原理为:
4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g) ΔH= -1632.4 K•mol-1。
该反应常温下 自发进行(填“能”或“不能”),请说明原因。
答案:能,反应后气体分子数变多,ΔS>0,又因为ΔH<0,肯定自发。
三、综合题型:
1、选择题:
利用CH4可消除NO2的污染,反应原理为CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),在10 L 恒容密闭容器中分别加入0.50mol CH4和1.2 mol NO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示。

下列说法错误的是
A.该反应为放热反应,M=0. 15
B.T1K下,0 ~10min内,NO2的平均反应速率为0.003mol•L-1•min-1
C.T2K下,化学平衡常数K=(0.0352×0·072)/ (0.015 ×0. 052)
D.T1K下,50min时再往容器中投入与起始等量的反应物,CH4的平衡转化率会增大
答案:D
分析:
A、考查反应速率的影响因素及平衡的建立:根据不同温度下同一时间的数据对比,T2反应速率快,T2的温度高。温度高时,达到平衡的时间更短。所以T2在40分钟时也达到平衡。数据与50分钟时的数据相同,为0.15。
B、考查反应速率的计算:
v=Δc/ΔT=[(0.5mol-0.35mol)×2/10L]/10min=0.003mol•L-1•min-1
C、考查计算平衡常数:
用三段法计算得:c(CH4)=0.015mol/L,c(NO2)=0.05mol/L,c(N2)=C(CO2)=0.035mol/L,c(H2O)=0.07mol/L,K=(0.035×0.035×0.072)/(0.015×0.052)
D、考查等效平衡的应用:
相当于增压,增压后平衡逆向移动,CH4的转化率减小。
2、综合题一:
工业上常用1-丁烯催化脱氢的方法制备1,3-丁二烯。将0.1mol 1-丁烯和0.675mol 水蒸气组成的混合气,在80KPa恒压下进行反应:
CH3CH2CH=CH2(g) CH2=CCH=CH2(g)+ H2(g) ΔH
CH2=CCH=CH2(g)+ H2(g) ΔH
请回答下列问题
(1)已知化学键能如下,
C-C:348 kJ/mol、C=C:612kJ/mol、C-H:412kJ/mol、H-H:436kJ/mol
由此计算ΔH= kJ/mol。
(2)如图表示脱氢反应中温度对1-丁烯的平衡转化率的影响,工业生产通常控制反应温度为600℃。
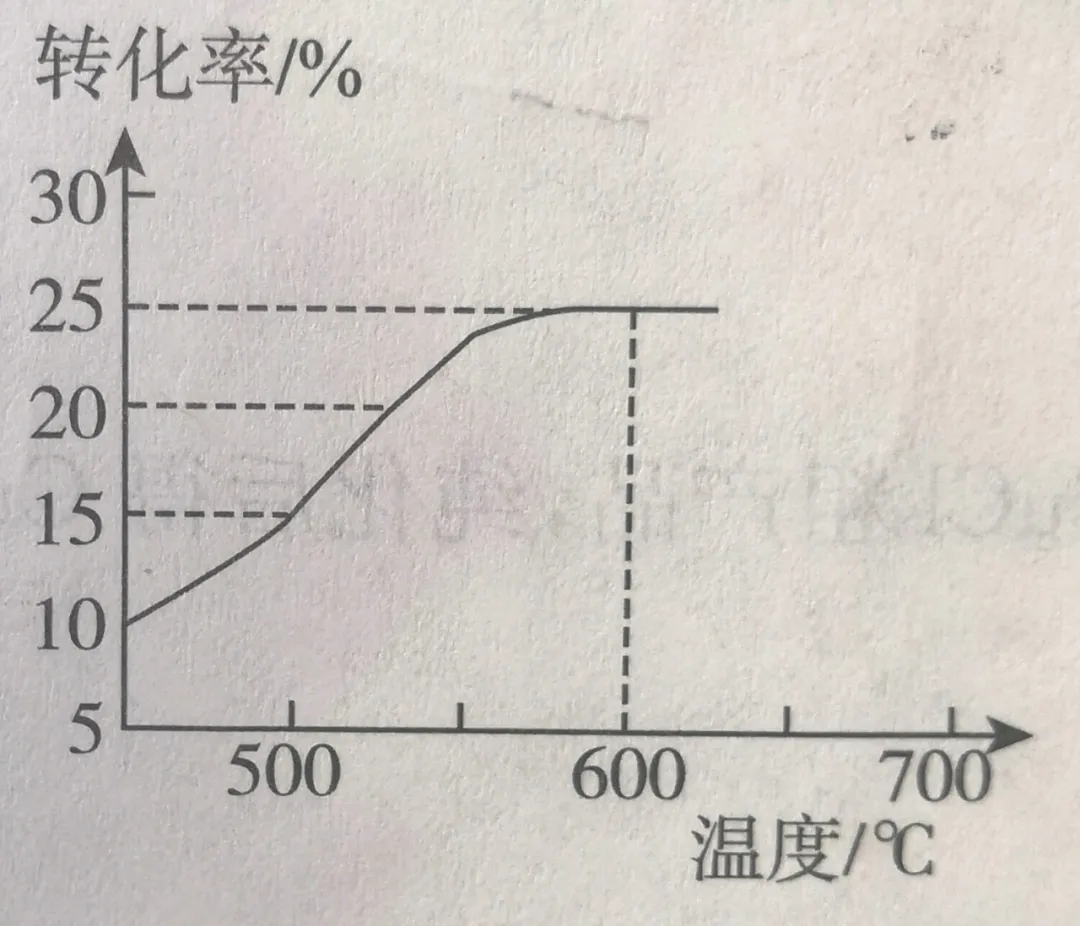
①请解释工业生产控制温度在600℃的原因 。
②此温度下反应进行2.5小时后,达到平衡,从开始反应到建立平衡,以H2表示的平均反应速率为v(H2)=KPa•h-1;脱氢反应的平衡常数KP= KPa。
(3)在密闭容器中反应达到平衡后,再充入1.575mol1-丁烯和1.625mol 1,3-丁二烯,化学反应向 (填“正反应”、“逆反应”或“不移动”)方向进行。
分析:
(1)考查用断成键理论计算ΔH
ΔH=断键吸收能量-成键放出能量
=(348 kJ/mol×2+612kJ/mol+412 kJ/mol×8)-(348 kJ/mol×1+612kJ/mol×2+412kJ/mol×2+436kJ/mol)
=+124 kJ/mol
(2)①考查条件对反应速率、平衡转化率影响
本反应吸热,温度升高,反应正向移动,转化率提高。
本反应使用催化剂,温度不是加快反应的主要因素,催化剂才是。但催化剂反应需要在一定温度下才有活性。工业反应温度使用600℃而没有采用更高温度肯定考虑了催化剂的活性。
所以本题的答案是:600℃时转化率较高,并且催化剂活性强。
②考查分压的求解:p分=p总压╳n/n(总)
利用三段法:
CH3CH2CH=CH2⇌CH2=CCH=CH2+H2
0.10 0 0
-0.025 +0.025 +0.025
0.075 0.025 0.025
n总=0.075mol+0.025mol +0.025mol +0.675mol=0.8mol
pH2=80KPa×0.025mol/0.8mol=2.5KPa
v(H2)=2.5KPa/2.5H= 1KPa•h-1
又考查了压强平衡常数的求解
pCH3CH2CH=H2=80KPa×0.075mol/0.8mol=7.5KPa
pCH2=CCH=H2=80KPa×0.025mol/0.8mol=2.5KPa
Kp=2.5KPa×2.5KPa/7.5KPa=5/6 KPa
(3)考查了Qp与Kp的比较
n(CH3CH2CH=CH2)=0.075mol+1.575mol=1.65mol
n(CH2=CCH=CH2)=0.025mol+1.625mol=1.65mol
n(H2)=0.025mol
n总=1.65mol+1.65mol+0.025mol+0.675mol=4mol
pH2=80KPa×0.025mol/4mol=0.5KPa
pCH3CH2CH=H2=80KPa×1.65mol/4mol=33KPa
pCH2=CCH=H2=80KPa×1.65mol/4mol=33KPa
QP=33KPa×0.5KPa/33KPa=0.5 KPa
Qp<Kp
反应向正反应方向进行。
3、综合题二:
NO2可发生二聚反应生成N2O4,化学方程式为2NO2(g)⇌N2O4(g),上述反应达到平衡后,
(1)升高温度可使体系颜色加深,则该反应的ΔH(填“>”或“<”) 0。
(2)已知该反应的正反应速率方程为v(正)=K正•c2(NO2),逆反应速率方程为v(逆)=K逆•c(N2O4),其中K正、K逆分别为正、逆反应的速率常数。则图(lgK表示速率常数的对数;1/T表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgK正随变化关系的是斜线,能表示lgK逆随1/T变化关系的是斜线。
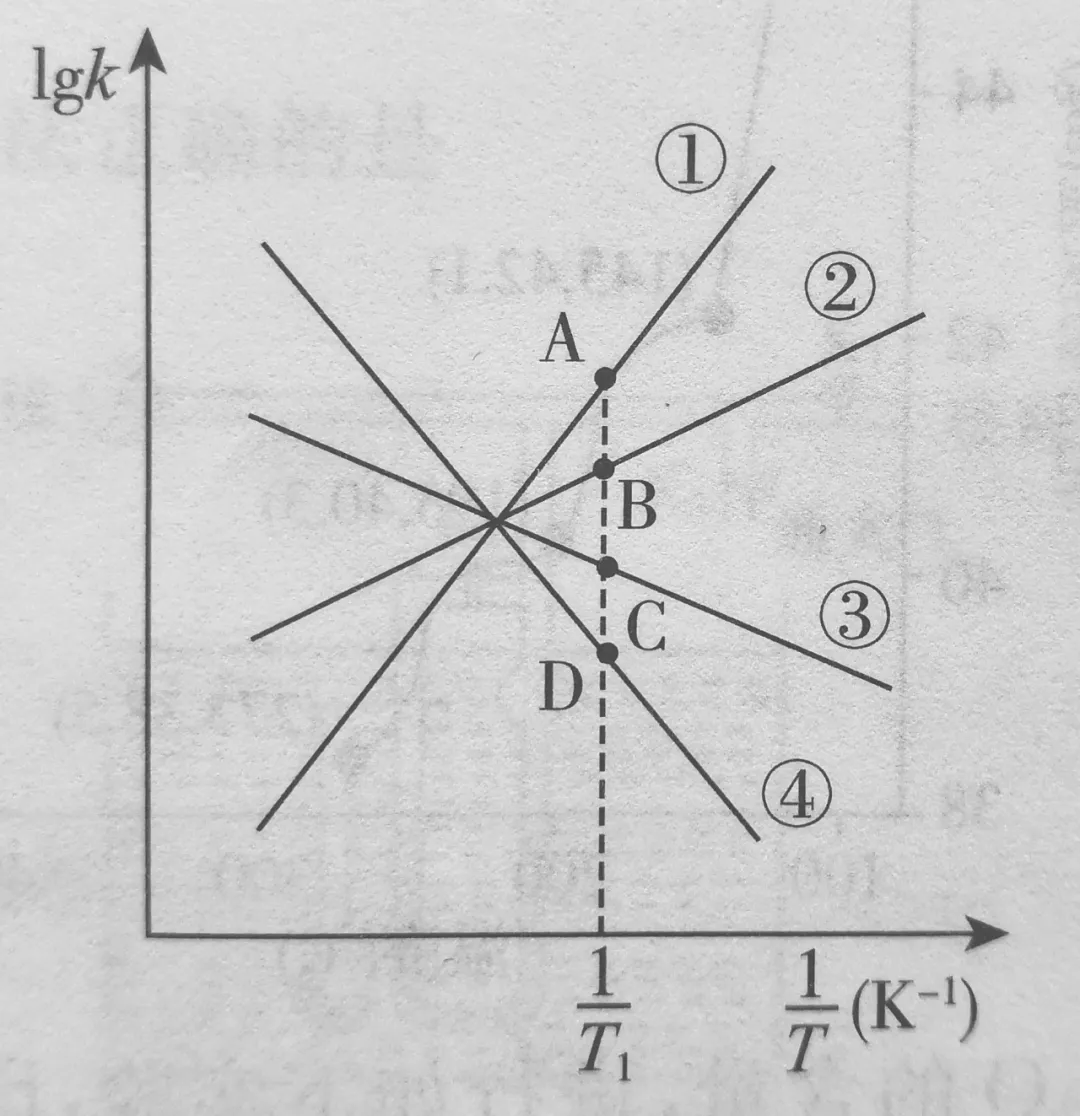
(3)图中A、B、C、D点的纵坐标分别为a+1.5、a+0.5、a-0.5、a-1.5,则温度T1时化学平衡常数K= mol•L-1。
(4)已知温度T1时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2mol•L-1,此时v(正) (填“>"或“<’’)v(逆)。
(5)上述反应达到平衡后,继续通入一定量的NO2,则NO2的平衡转化率将 ,NO2的平衡浓度将 (填“增大”,“减小”,或“不变”)。
分析:
(1)考查化学平衡移动原理
升温向吸热方向移动,本题逆向移动,所以正反应放热,ΔH<0。
(2)考查了温度升高与速率常数之间的关系
速率=速率常数╳浓度幂:升温瞬时,浓度并不变,而正、逆反应速率都提高,说明正、逆速率常数都变大。
坐标向右表示降温,lgK减小,③④可能表示K正或K逆。
又因为降温后平衡向正向移动,v(正)>v(逆),说明K正减小得慢。
所以③表示lgK正,④可能lgK逆。
(3)考查了利用速率常数解平衡常数
平衡常数的表达式为K= c(N2O4)/c2(NO2)
速率的表达式为v(正)=K正•c2(NO2),v(逆)=K逆•c(N2O4)
两者有相同的数据,需要找到两者在平衡时的联系。
在平衡时,v(正)= v(逆),所以K正•c2(NO2)=K逆•c(N2O4)
c(N2O4)/c2(NO2)=K正/K逆
通过(2)的分析,T1时,lg K正=a-0.5,则K正=1╳10a-0.5;lg K逆=a-1.5,则K逆=1╳10a-1.5
c(N2O4)/c2(NO2)=(1╳10a-0.5)/(1╳10a-1.5)=10
K=10 mol•L-1
(4)考查了利用Qc与K的比较判断反应方向
Qc= c(N2O4)/c2(NO2)=0.2/0.22=5mol•L-1
Qc<K,平衡正向移动,v(正)> v(逆)。
(5)考查了等效平衡的应用:充气问题
等效于增压,平衡正向移动,NO2转化率提高。但平衡时NO2的浓度提高。
四、难点问题
1、关于活化能图像的应用
我国科学家实现了在铜催化条件下将DMF[(CH3)2NCHO]转化为三甲胺[N(CH3)3]。
计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示
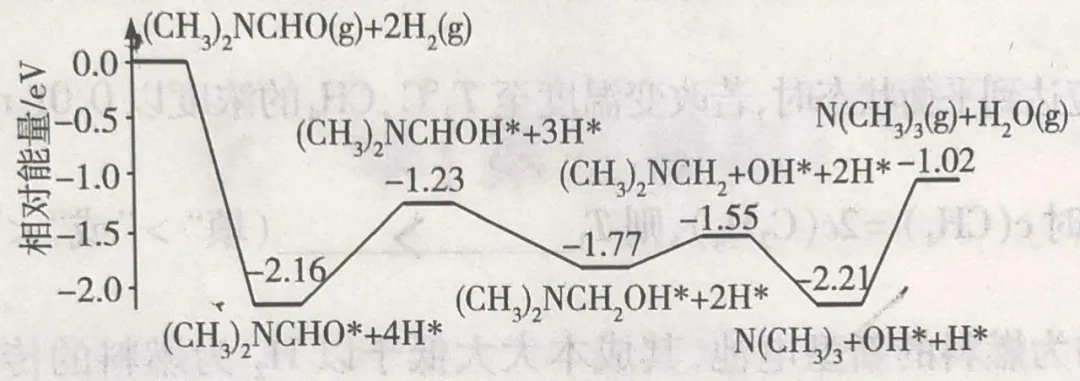
下列说法正确的是
A.由图可以判断DMF转化为三甲胺的反应属于吸热反应
B.N(CH3)3+OH×+H×=N(CH3)3(g)+H2O(g)是该反应历程的决速步
C.使用铜作催化剂可以降低反应的活化能,从而改变反应的焓变
D.该历程中最大能垒(活化能)E正=2.16 eV
答案:B
分析:
A、从起始点到终点可以看出此反应为放热反应。
B、此反应的活化能最高,反应速率最慢,是决定反应速率的关键步骤。
C、催化剂能降低活化能,加快反应速率,但不能改变焓变。
D、最大活化能是b选项中的反应,能垒为1.19eV。
2、数据转换的计算
反应2CH4(g)⇌C2H2(g)+3H2(g)发生过程中,CH4还会发生副反应2CH4(g)⇌C2H4(g)+2H2(g),其他条件一定,测得平衡时几种气体的lg p(p表示分压,单位为Pa)与温度的关系如图所示。
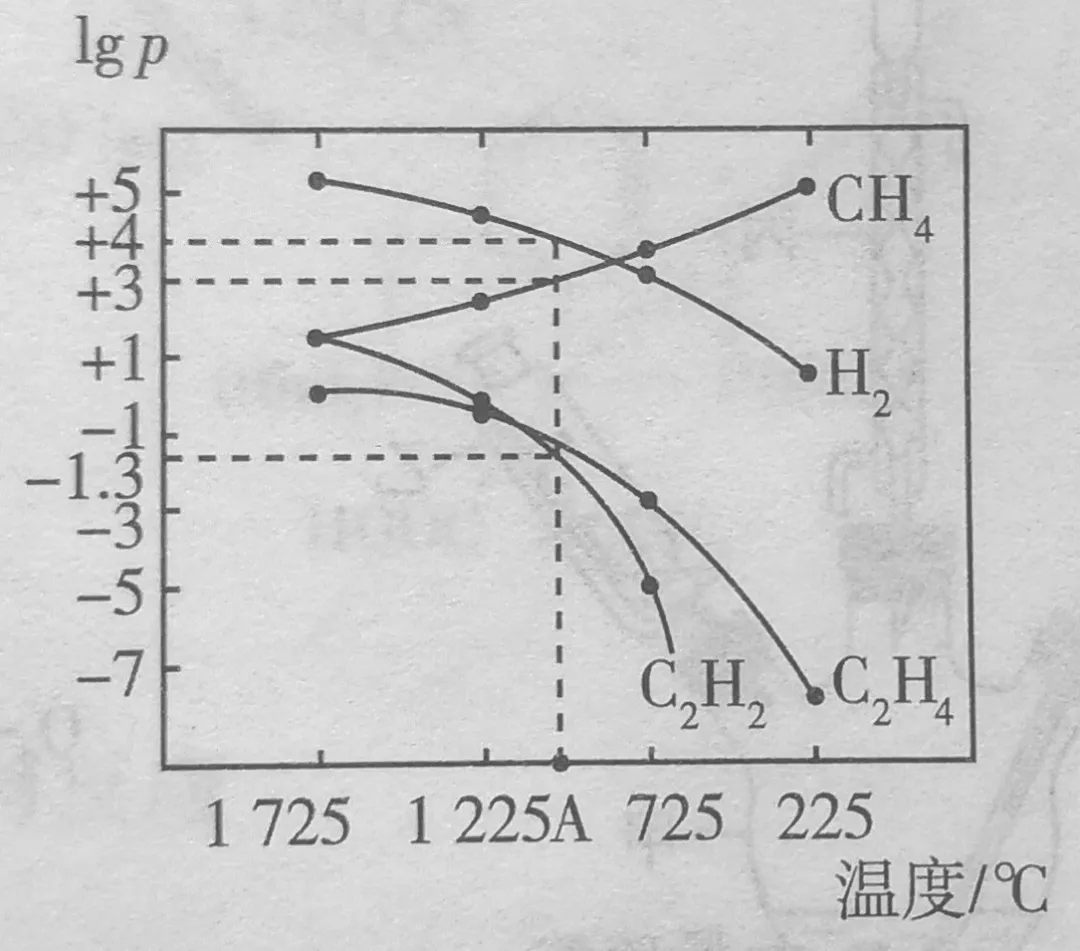
列式计算反应2CH4(g)⇌C2H2(g)+3H2(g)在a点温度时的平衡常数Kp=(用平衡分压代替平衡浓度计算,lg(0.05=-1.3)。
答案:5╳104Pa2。
分析:
A点的数据为:p(CH4)=+3、lgp(C2H2)=-1.5、lgp(H2)=+4
解得:p(CH4)=1╳103Pa、lgp(C2H2)= 1╳10-1.5Pa=0.05Pa、p(H2)= 1╳104Pa
代入平衡常数表达式得:K=[0.05Pa╳(1╳104Pa)3]/(1╳103Pa)2=5╳104Pa2
3、多个平衡在同一体系中,共用同一种物质形成平衡时的计算
共用的同一种物质不进行拆分,物质的总浓度作用于每一个平衡。
用Fe2O3干法脱除NH3涉及的部分反应及平衡常数KP的对数值与温度的关系如下:
①NH3(g) +9/2Fe2O3(s)⇌1/2N2(g) +3Fe3O4(s) +3/2H2O( g) ΔH1
②NH3(g) +6Fe2O3(s)⇌1/2N2O(g) +4Fe3O4(s) +3/2H2O(g) ΔH2
③NH3( g) +15/2Fe2O3(s)⇌NO(g) +5Fe3O4(s) +3/2H2O(g) ΔH3
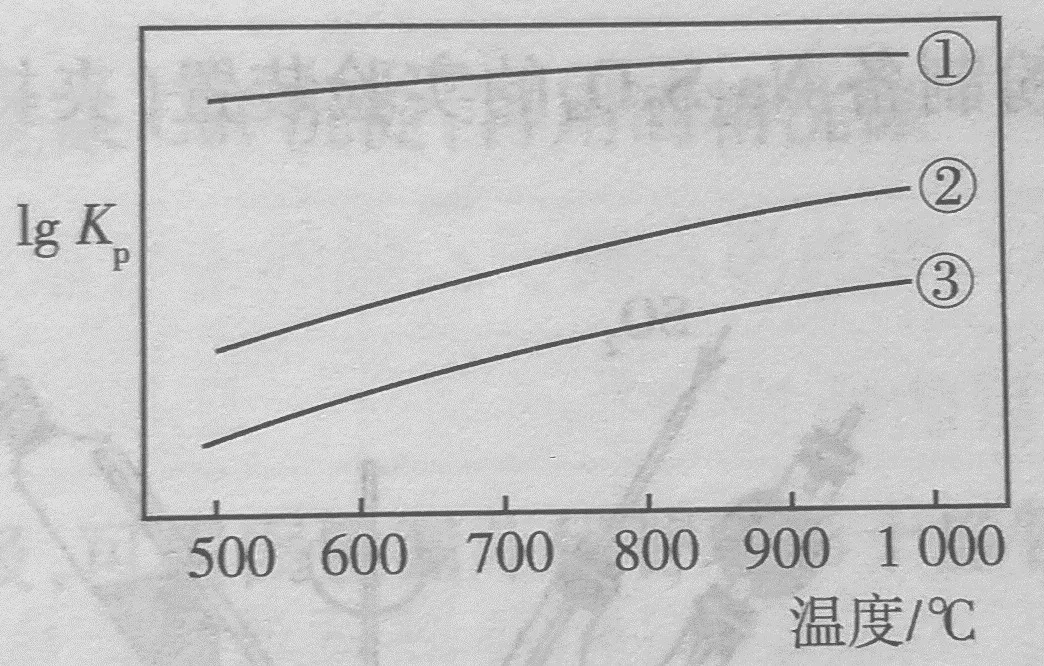
若一定条件下,向体积为V L 的恒容密闭容器中加入2mol NH3和足量Fe2O3发生上述反应,达到平衡时,容器中N2、N2O、H2O分别为a mol、b mol、c mol,此时NO(g)的浓度为 mol•L-1(用含a、b、c、V的代数式表示),该温度下反应③的平衡常数为 。
答案:(2/3c-2a-2b)/V,[(c-3a-3b)╳(c/V)3/2]/(3-c)
分析:
(1)利用N2、N2O、H2O分别是amol、b mol、c mol,求出③生成的水为c-3a-3b mol。然后求出NO为(c-3a-3b)╳2/3= 2/3c-2a-2b mol。
(2)根据三个反应中H2O与NH3的相同比例,求出剩余的NH3为2-(2/3)c mol。
(3)体系中总的剩余的NH3和体系生成的总的水作用于每一个平衡。
c(H2O)=c/V mol•L-1;c(NH3)=[2-(2/3)c]/V mol•L-1;c(NO)=(2/3c-2a-2b)/V mol•L-1
代入表达式,得
K=[(c-3a-3b)╳(c/V)3/2]/(3-c)
4、平衡数据不正常变化的原因分析
ScR催化法是工业上消除NO的常用方法,其原理为:4NH3(g)+4NO(g)+O2(g)⇌4N2(g)+6H2O(g) ΔH= -1632.4 kJ•mol-1。
NO和NH3在有氧条件及Ag2O催化作用下,当反应温度升高到550~700℃时,NO转化率明显下降,NO2产率明显上升(如图所示)的原因可能是 (用化学学方程式表示)。
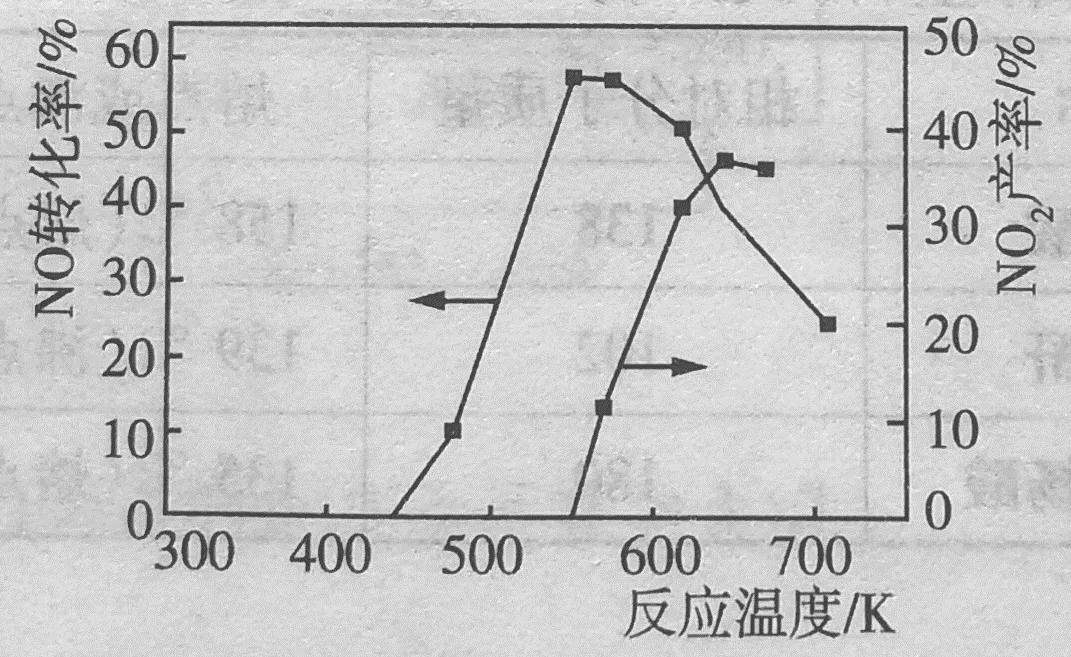
答案:4NH3(g)+7O2(g)⇌4NO2(g)+6H2O(g)
分析:
有些同学会分析为2NO+O2=2NO2,或Ag2O分解出O2造成O2的浓度提高,发生2NO+O2=2NO2。这两种分析的问题在于,NO的转化率都是提高的。
NO的转化率明显降低,是指NO不再参与反应。而产生的NO2产率明显上升,只能是NH3与O2反应所致。
5、分压计算并求反应速率(或平衡常数Kp):
利用测压法在刚性反应器中研究800℃时NO(g)与O2(g)的化合反应:
2NO(g)+O2(g)=2NO2(g)
2NO2(g)⇌N2O4( g)
其中NO(g)与O2(g)化合的反应为不可逆反应,NO2二聚为N2O4的反应可以迅速达到平衡。起始投料比n(NO):n(O2) =1:1,体系的总压强为33.2 KPa。
NO(g)与O2(g)化合的反应速率v=4.2╳10-2╳p2(NO)╳p(O2)(KPa•min-1),t=52 min时,测得体系中p (NO) =6.2 KPa,v= KPaKPa•min-1(计算结果保留1位小数)。
答案:18.4。
分析:
在恒容容器中,反应前后的分压之比,等于物质的量之比。(在恒压体系中不一定)
反应前NO(g)与O2(g)的物质的量相等,则分压相等,p(NO)=p(O2)=16.6KPa,利用三段法计算:
2NO(g)+O2(g)=2NO2(g)
16.6KPa 16·6KPa
-2x -x
6.2KPa
x=5.2KPa
解得反应后p(O2)=11.4KPa,代入表达式
v=4.2╳10-2╳6.22╳11.4KPa•min-1=18.4KPa•min-1
6、通过处理数据进行问题分析
在0.1 MPa下,将总进料量1 mol 且n(CH3OH):n(H2O)=1:1.3的混合气体充入一刚性密闭容器中反应。
CH3OH(g)⇌CO+2H2 ΔH>0
CO+H2O(g)⇌CO2+H2 ΔH<0
平衡时,测得CH3OH的含量在给定温度范围内极小,H2、H2O(g)、CO、CO2四种组分含量与反应温度关系如图所示。试解释a的含量约是b的含量3倍的原因。
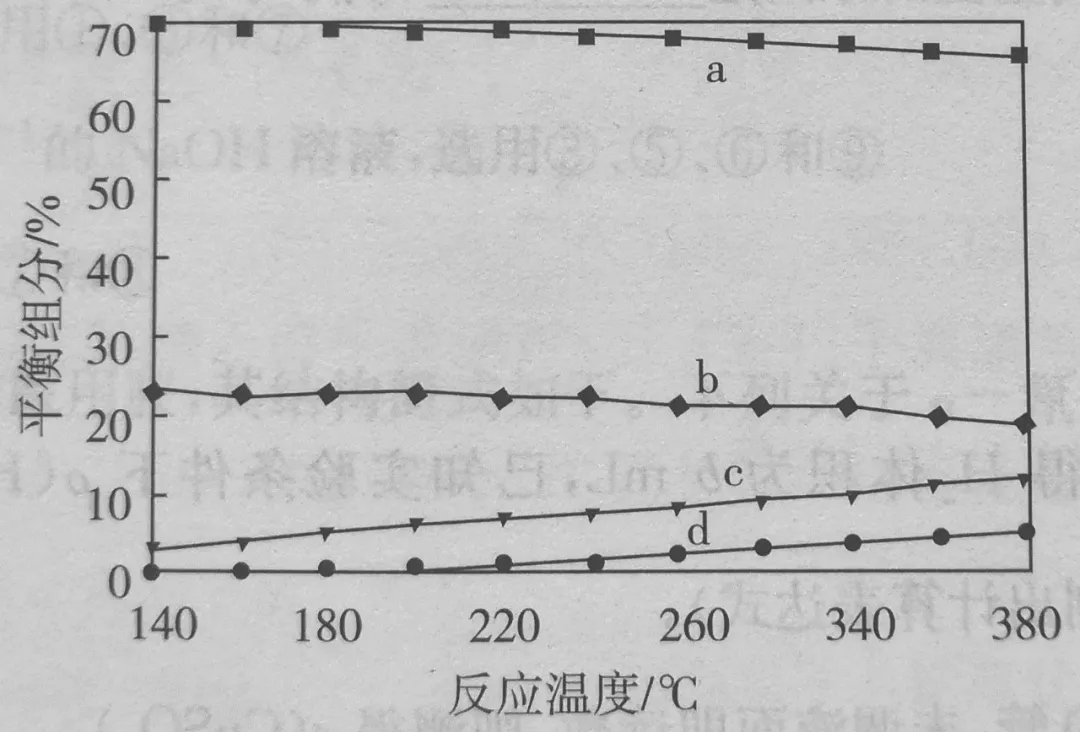
答案:a为H2,b为CO2,当CO的转化率很大时,CO2的产量与H2的产量之比约为1:3。
分析:
利用三段法计算分析:
CH3OH的含量在给定温度范围内极小。假设CH3OH全部反应
CH3OH(g)⇌CO+2H2
1 0 0
-1 +1 +2
0 1 2
将数据代入第二个反应,采用两次假设
CO+H2O(g)⇌CO2+H2
1 1.3 0 2
0 0.3 1 3
若几乎不反应,则平衡组分的比例H2:H2O:CO:CO2=2:1.3:1:0,这与图像不符。
若几乎完全反应,则平衡组分的比例H2:CO2:H2O:CO =3:1:0.3:0,这与图像基本符合。
【练习】
1、用Fe2O3干法脱除NH3涉及的反应如下:
①NH3(g) +9/2Fe2O3(s)⇌1/2N2(g) +3Fe3O4(s) +3/2H2O( g) ΔH1
②NH3(g) +6Fe2O3(s)⇌1/2N2O(g) +4Fe3O4(s) +3/2H2O(g) ΔH2
③NH3(g) +15/2Fe2O3(s)⇌NO(g) +5Fe3O4(s) +3/2H2O(g )ΔH3
反应2NO(g)+N2(g)⇌2N2O(g)的ΔH= 。(用ΔH1、ΔH2、ΔH3表示)。
2、CO甲烷化反应为:CO(g)+3H2(g)⇌CH4(g)+H2O(l)。下图是使用某种催化剂时转化过程中的能量变化(部分物质省略)。(已知CO的分子结构与N2相似)
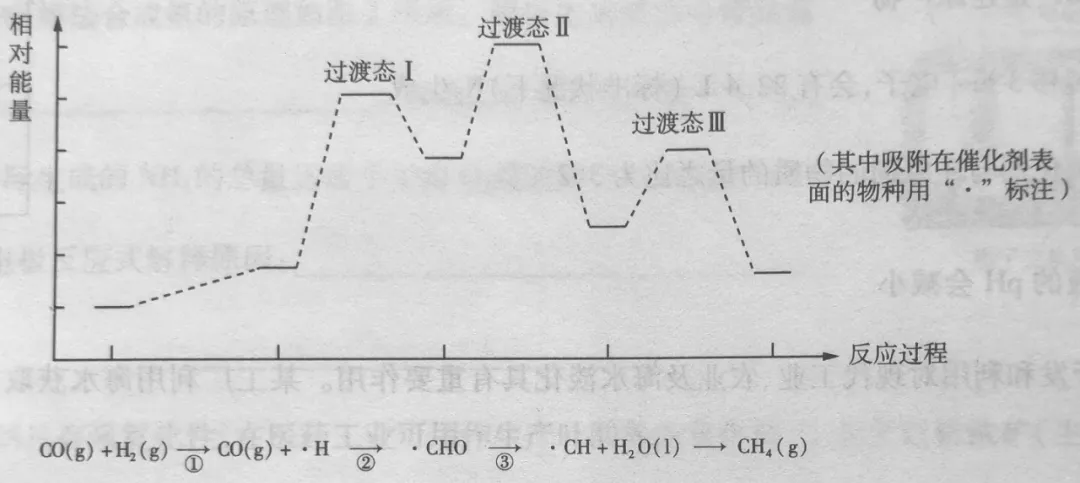
下列说法正确的是
A.步骤①、②、③均为吸热过程
B.步骤②中只有极性键的形成,没有极性键的断裂
C.反应速率:③>②
D.使用催化剂可降低该反应的焓变,从而使反应速率加快
3、向容积为2L 的真空密闭容器中加入活性炭(足量)和NO,发生反应
C(s)+2NO(g)⇌N2(g)+CO2(g)ΔH>0
NO和N2的物质的量变化如表所示,反应在T1℃、T2℃下分别达到平衡时容器的总压强分别为P1KPa、P2KPa。
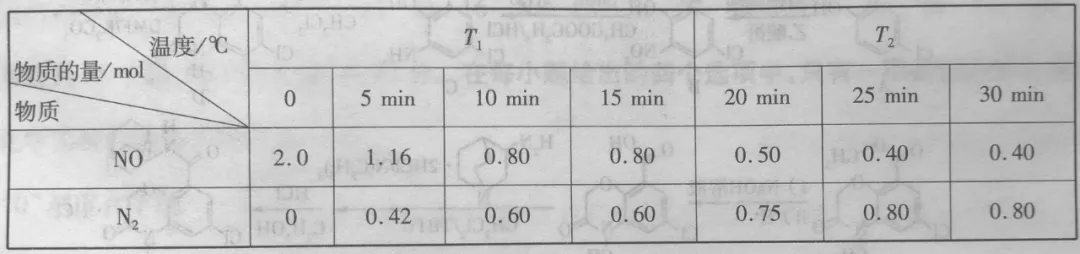
下列说法错误的是
A.T1℃时,0~10min内,以NO表示的反应速率v(NO)=0.06p1KPa•min-1
B.T1℃下,反应的平衡常数为9/16
C.第15 min后,温度调整到T2℃,数据变化如表所示,则p1>p2
D.若30 min时,保持T2℃不变,再加入三种气体物质各2 mol,再次达平衡时NO的体积分数为20%
【练习答案】
1、4ΔH2-2ΔH1-2ΔH3
2、C
3、C

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一、数列的表达式问题 例:(2019高考全国卷Ⅲ)直链的多磷酸盐是...
晶体中某原子或离子的配位数:是指离中心原子或离子最近的原...
在“难点四:突破电子式书写的困惑”中,已经详细介绍了利用...
1 、熟悉常见的有机合成路线 RCH=CH 2 → RCH 2 CH 2 X → RCH 2 CH 2 O...
现在很多简单的实验考查,常常不再考查明显的实验错误,而是...
一、对于高一的初学者,CO 2 通入NaOH溶液反应的过量问题,为什...