
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在化学的研究与学习中,为简洁地表述某化学过程,常常要借助于化学反应方程式(简称为化学方程式)。化学方程式是将某化学反应涉及的反应物和生成物都用化学式表示出来,用一些特定符号来衔接,以物质不灭定律为依据,而书写出来的一个式子。它是化学的基本语言。
要完整地描述出一个化学变化,通常需要从四个方面来考虑。即:反应物及生成物的物理性质(如物态、颜色、气味、密度),反应进行的条件,反应的激烈程度,各化学物质的组成及其相互间物质的量关系。
化学反应方程式显然更侧重于从上述四项的最后一个方面,也是其中最本质的、最有“理论”价值的方面,来描述一个化学反应。作为反应方程式,必须要能表达出,各化学物质的组成及其相互间物质的量关系。
对其它三个方面,人们则可以有选择性地“采纳”到化学方程式中来,抑或将其“忽略”。这是由于,相关的信息太多,难于面面俱到;二则,需要给出哪些信息,往往是由客观需求及人的主观意愿来决定的,给出的“信息”过多,反而有画蛇添足的嫌疑。
所以让化学反应方程式采取哪种表现形式,反映出多少化学信息,本来就是一个要由“需要”及“习惯”来加以制约的问题。不会有一个统一的标准。
一、中学化学教材中关于化学反应方程式的书写规则
由于化学方程式在化学学科中的重要性,以至于学生在初接触化学时,就要告诉学生,如何阅读及如何来书写化学反应方程式。所以,在初中化学第一册中一直就存在有名为“化学反应方程式”的一节。
在不同时期的初中教材中,对化学方程式的书写要求是有差异的。共同点是:写出所有反应物及产物的化学式;彼此间用“+”号、反应物端与产物端用“=”号连接;生成物端有沉淀或者气体产生时,要用“↑”号或“↓”号表示出来;在“=”号处标注反应条件。
但这些教材中的表述,在某些方面也还是有着细微差别的。可见教材编写者的良苦用心。
如:在上世纪八十年代的教材中,虽有“如果生成物中有沉淀或者气体产生,一般应该用“↑”号或“↓”号表示出来”的要求,但并无更为实质性的说明文字。只是写了3个如下的反应方程式作为“注解”:
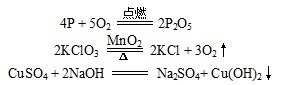
以便让学生去领会,在反应前后都有固态物质的情况下(上述3个反应中最上一个反应),产物端的固态物质是不用添加“↓”号的。
其他的情况呢?教材并没有说明。这当然就给当时的化学教学带来了某些麻烦,使部分愿意思考的学生、甚至于一些教师产生了一个可以去想象的空间。
在最新版的统编初中化学教材中,这个问题似乎得到了进一步地解决。
改进一,对“生成物中有固体,在固体物质的化学式右边要注“↓”号”的附例CuSO4+2NaOH = Na2SO4+Cu(OH)2↓,加了一个注释,指出“这是在溶液中的反应”。将“↓”符号的使用范围严格限定在溶液反应的条件下。
这样,符号“↓”就只能是“沉淀生成”的代名词。学生也就不会犹豫在反应“NH3+HCl = NH4Cl”的右端,要不要再加“↓”符号了。因为这是个气相反应,不是溶液中的反应,不用加“↓”。
改进二,还指出:如果反应物和生成物中都有气体,气体生成物就不需注“↑”,同样,如果反应物和生成物中都有固体,固体生成物也不需注“↓”。并举例有:
![]()
实际是告诉学生,只有当体系中有新相生成时才能使用符号“↑”或“↓”。使符号贴近了与“反应现象”间的联系。因为人的眼睛看不出O2与SO2气体间的区别,而感知宏观相变的功能还是有的。
但,将符号“↑”或“↓”直接与“反应现象”挂钩,还是有一些问题的。
从P在氧气中燃烧的反应人们自然会想到,作为一个经典的粗略测定空气组成的实验的一部分。其后还有操作,将密封的反应容器倒扣在水中,打开瓶塞,看水面上升,直至瓶中的气体减少约1/5左右,以解释其余的4/5是氮气。就这个气体减少的反应,为更精确地描述出“反应现象”,把反应物端的气体也用符号“↑”表示出来,不是更好吗?
如果要描述反应现象,对反应“FeS + 2HCl = FeCl2+H2S”,也应该在“H2S”后加“↑”的同时,在“FeS”的后面也加“↓”,以表示固体物质的溶解和气体物质的生成,这才合理。
为什么不这样来规定呢?
二、化学反应方程式书写的多样性
从中学化学教学的圈子跳出来,就会遇到更多的化学反应方程式。
首先,我们都能想到的就是热化学方程式。
当同时还要研究某化学反应的化学热力学函数变及有关的一些信息时,就要考虑各化学物种所处的物态了,因为这时各物种的物态对化学热力学函数变的数值都有显著影响。这样,从一般的化学反应方程式就衍生出来了一种特殊的——热化学方程式。如,
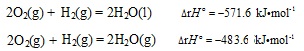
两者仅由于反应产物的物态不同,其恒压反应热就产生了很大的差别。当然,这两个反应的标准熵变及标准自由能变也都是各不相同的。
所以,在热化学方程式中必须要标明各物种的物态。但即使这样,在热化学方程式中也没有符号“↑”或“↓”的位置。
随便翻翻手头的几本大学化学教材,虽然有相当多的化学方程式符合中学教材的要求,“正确”地使用了符号“↑”与“↓”,但没有按照这些“规定”来写的也不在少数。如:
1.HgS + O2= Hg + SO2↑(北京师范大学等校《无机化学》)。在反应物端有气体的情况下,给产物端的“SO2”也标出了气体符号“↑”。
2. H2O2+Mn(OH)2↓=MnO2↓+ 2H2O(武汉大学等校《无机化学》)。两端都有沉淀符号。
3. P4+3KOH + 3H2O→pH3+3KH2PO2(大连理工大学《无机化学》)。产物端的气体“PH3”没有用气体符号“↑”标出。同时,代表反应过程的等号也改成了箭号“→”。
4. CaF2+H2SO4→CaSO4+2HF([英]J.D.李氏《新编简明无机化学》)。作为制取HF的反应,反应物端的硫酸后面没有标记出“(浓)”字。产物端的HF后面也没有加“↑”的标记。
5. HC≡CH + 2AgNO3+2NH4OH→Ag-C≡C- Ag + 2NH4NO3+2H2O
乙炔银(白色)
(吉林师范大学等校《有机化学》)。对乙炔银没有标出“↓”。且在化学式“Ag-C≡C- Ag”的下面还给出了其名称及颜色。
这些反应方程式的书写都不符合中学化学的要求。但它们是错误的吗?
说心里话,不能说它们是“错误”的,只能说“感觉是怪怪的”。“没错”的理由是,它们都准确地表述出了反应前后各物种的组成,及各物种间的计量关系,都具有化学方程式的基本功能。有的还“别有新意”,提供出了一些“额外”的信息。
另一方面则是“不满”,它们都违反了中学教学中有关化学方程式写法的“规定”,不够“规范”。
但中学教学的“规定”又是从何而来的呢、为什么要做这样的规定呢?
三、中学化学反应方程式书写“规则”的不合理性
将上述5个所谓“错误”的反应方程式,与中学化学方程式的书写规则比较,可以概括成有以下3点的不同。从这些“不同”,不难分析出“中学化学方程式书写规则”的不合理性。
第一个不同,反应物与产物端间,有的方程式没用等号“=”,而是用箭号“→”来连接。
这可以被理解为,在中学化学教学中,学生对化学方程式的配平还不很熟练,有必要用单线号“一”号来表示未配平的反应方程式,而配平的方程式才能画等号,这样两者间的区别才显著,不容易看错。加之,中学生对可逆反应的概念也不很熟悉,等号易于与可逆符号相比较与关联。
而对大学生来说,“配平”则已不是问题,而箭号“→”写起来不但简单,还可以画的较长,更便于标注出多个反应条件,用起来会方便些。
所以,等号与箭号在本质上相同,相互间本就没有什么“差别”。在不同的学习阶段,它们都是可以被采用的表示方法。
第二个不同,有些重要的反应条件或物态没有标注出来。
如标题号为“二、3”的有PH3气体生成的反应,在PH3的化学式后没有添加“↑”符号。标题号为“二、4”的制取HF的反应,在硫酸的化学式后没有添加“(浓)”字。标题号为“二、5”的反应中,对乙炔银的沉淀没有标记。
这要从三个方面来理解:
首先,要考虑化学方程式是写给谁看的,要达到什么目的?对于有足够化学知识的人,当一看到这个反应方程式,就可以知道产物的物态,或能估计出其反应条件时,对反应方程式就可以不进行这些标注。
如对白磷与氢氧化钾溶液的反应,当学生已有常温下PH3是气体这个概念的前提下,没有必要再在化学方程式中来重复这个知识点。
又如对制取HF的反应,当学生想到HF极易溶解于水,就会联系到要用浓硫酸来反应;考虑到HF能够腐蚀玻璃,就知道反应不能在玻璃器皿中进行。给有较多化学知识的读者写这样的反应方程式,是不用标出这些“一般”反应条件的。
对“二、5”反应,则学生可能已通过实验验证了沉淀的生成。何况乙炔银下面注有“白色”的字样,也说明了它是沉淀。
在化学教学中教师也常常会有意的,在学生第一次接触到某反应方程式时,会把物态及反应条件标注的详细一些。在多次重复这个方程式后、再遇到它时,就可以少标注,甚或不标注这些学生已掌握的信息。
其次,看要反应方程式想给读者传递出哪些信息。如果就是告诉读者CaF2的用途,或仅是让读者计算理论上一定量CaF2可以制备出多少HF,都没有必要再标记出硫酸是浓的。
也就是说,反应条件并不是必须要标记出来的。当读者不需要某“反应条件”的信息时,就可以不标注。
另外,化学反应进行的条件还可以用文字的形式给出。在用文字进行介绍后,再给出反应方程式;或者在反应方程式后的括号中加文字进行补充。
如,在文字“点燃的木炭在装有氧气的集气瓶中继续燃烧”后,所附的反应方程式“C + O2= CO2”中,不重复注明反应条件“点燃”,也是可以的。
第三个不同,有些反应中有一些多余的标记或文字。
如“二、2”反应物端的“Mn(OH)2↓”。“二、5”中“Ag-C≡C- Ag”下的文字“乙炔银(白色)”。都属于,打算提供给读者更多的化学信息,且无损于化学方程式本质的情况。
在教学中,也常有教师在化学方程式中的某化学式后标注其颜色、名称、稳定性等情况的。这都属于因地制宜、因情况而异,在特殊情况下丰富化学方程式内涵的举措。没有什么可以挑剔的。
对某化学反应来说,其化学反应方程式的核心在于,给出用化学式表示出各物种的组成,及按照物质不灭定律而写出各物种间的物质的量关系。至于其他标记都属于“锦上添花”,由需要和可能性而定的内容。
看来,中学化学中有关化学反应方程式的书写规则中,要求将反应条件和产物端的某些种物态要表达出来,是一个有些高的标准。连一些编写教材的专门家都比较难于做到。
但从另一个角度来看,这也说明,中学化学方程式书写规则本身也有其不合理性。
四、制定中学化学反应方程式书写“规则”的动机
行动都是为目的服务的。在中学化学教学中,强调化学方程式要标出反应条件与产物物态的目的何在?
对于一个“标出反应条件及产物物态”化学方程式,最先能想到的,就是它传递出了更多的化学知识。让人们对反应条件及化学物质的物态有更多的了解。
在中学化学教学中,由于学生需要掌握的化学知识相对较多,常有忽略反应条件的倾向。为此而强调反应条件的记忆是应该的,多次重复也能使学生养成一个重视反应条件的学习化学好“习惯”。
但只突出产物端的物态,还要注意与反应物端物态间的区别,同时要用符号醒目地标记出来,这究竟又是为了什么呢?
讨论可以从中学教学中的几个重要反应类型来入手。看产物端物种的“物态”,是否能传递出某种超越其本身的、额外的功能。
对分解反应2KClO3= 2KCl + 3O2↑,符号“↑”仅具有表示其物态的作用。其实学生写产物端的“O2”时,默念的就是其名称“氧气”,怎么能不知道它是气体呢?,写不写这个符号的意义不大。
对化合反应C + O2= CO2,粗看一下就知道,这类反应几乎都没有可能在产物端写出气体或沉淀符号。显然,化合反应与产物端物态的标记问题无关。
对置换反应Zn + 2HCl = ZnCl2+H2,学生也都知道“H2”,的名称是“氢气”,否则连该分子式也写不出来。既然知道是氢气,还要用“↑”符号来标记,也没有什么意义。
这样,就只剩下一个“复分解反应”了。
写出FeS + 2HCl一FeCl2+H2S,
CuSO4+2NaOH一Na2SO4+Cu(OH)2,
Na2SO4+Cu(OH)2一CuSO4+2NaOH,
这样的三个反应。我们就会“眼前一亮”,似乎已经看到答案了。
因为,根据中学生的化学知识和理论水平,即使是写出这样的三个化学方程式,他们也不知道哪个反应能进行完全,哪个反应方程式是能成立的。
当酸、碱、盐相互间有可能的反应时,中学生必须采用如下的分析方法:先将共存于水中的两种电解质阳离子(或阴离子)按化合价进行交换(得到类似上面的式子);然后根据产物中是否有“沉淀、气体、水或其它弱电解质”,来判断反应是否完全;如果产物中有这几种物质中的一种,那么该复分解反应就能够进行完全,可将其配平、并将横线改为等号;如没有“沉淀、气体、水或其它弱电解质”,则复分解反应不能进行,不能写出这个反应方程式。
也就是说,对上述的三个反应中的第一个反应,只有在判断出产物端的“H2S”是气体的前提下,才能得出它能完全进行的结论;第二个反应的产物端有“Cu(OH)2”沉淀,也可以进行完全;而第三个反应的产物端既没有水及其它弱电解质,也没有气体或沉淀生成,所以不能进行,如写出该反应方程式则是错误的。
将上述判断过程的要点用符号标记出来,就是下面的样子:
FeS + 2HCl = FeCl2+H2S↑,
CuSO4+2NaOH = Na2SO4+Cu(OH)2↓,
Na2SO4+Cu(OH)2≠CuSO4+2NaOH,
可以看出方程式产物端有符号“↑”或“↓”作为标记的复分解反应,都是能进行完全的。最下面的反应没有这些标记、也没有弱电解质,因而无法进行。在这里符号“↑”或“↓”绝不再仅是一个物态的标志,而是关系到方程式能否成立的决定性因素。这就是中学教学中规定,在反应方程式的产物端要标出沉淀或气体的根本原因。
在化学方程式书写中,强调在产物端要标出“↑”和“↓”,竟然只是在为复分解反应的教学做铺垫。可见教材编写要考虑到多少问题,一个知识体系构建有多大的难度。
当然,在中学化学教学中还有一类比较重要的“复杂一些的氧化还原反应”,其产物端也可能会出现气体或沉淀。但对其标出符号“↑”和“↓”的意义也不大,属于可标可不标的范畴。
五、关于中学化学如何处理化学方程式一节教学的一些看法
现行教材较以往的教材在总体质量上有大幅度的提高,这点毋庸置疑。但还有一些值得商榷的地方。
1.为说明可以用反应方程式来进行化学计算。教材举例:“计算碳、与氧气完全反应、及产物,相互之间的质量比”,并给出计算的示例如下:
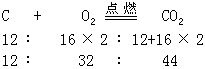
不难看出,在所依据的反应方程式中,等号上的“点燃”两字是多余的。
它不利于学生抓住用化学方程式进行计算的本质,即配平的化学方程式仅靠化学计量数和化学式量,给我们提供出各物种间的质量比及物质的量比。能写出配平的化学方程式就可以进行计算了。而其余的反应条件、物态符号都是“多余”的。写出这些条件来不会有加分,还耽误时间。
教材不要给学生这种,做无用功的示范。不要进行这种过于“严格”的“规范”。
2.基于在化学方程式中,连接反应物与产物间可以用“等号”,也可以用箭号“→”。是否可以说明,教材只把“等号”作为目前教学的一个选项。虽不必介绍可以用箭号,但起码要让学生在其它地方看到有箭号的化学方程式时,能知道这也是化学方程式、并不是其它的东西。
3.关于反应条件的标注,是否可以表述出“允许有一定的灵活性”,体现出不是必须要标记出来的。而改为“在有必要时,可以在等号处标明主要反应条件”。
4.由于目前在各类型的化学反应中都可见到标有“↑”或符号“↓”的反应方程式。所以在“化学方程式”一节可以解释说“在产物端常有标出气体或沉淀的情况”。知道这两种符号的含义就可以。
由于“↑”或“↓”符号仅对讨论复分解反应有帮助。教材及教师在讨论一般的化学反应(非复分解反应)时,都不要再标注这两种符号。
最好到讲授“复分解反应”时,再结合“反应完全进行的条件”来讲这两种符号的使用。
5.教材中的观点“如果反应物和生成物中都有气体,气体生成物就不需注’↑ ’”,是没有意义的。因为这类反应几乎都不是复分解反应(如教材所给的S + O2= SO2)。而像NaCO3溶液吸收SO2气体的反应,由于产物复杂,不会进入中学教学范围;实验室中用NaCO3吸收少量的HCl气体,一般也不会到有CO2气体析出的程度。
强调“反应物和生成物中都有固体,固体生成物也不需注’↓ ’”,也是没有意义的(如教材所给的反应4P+5O2=P2O5),也没有抓住关注点在于复分解反应的本质。
应该落实到“复分解反应”上来。而强调“对复分解反应来说,当产物端有气体生成时,要用’↑ ’来标注;当产物端有沉淀生成时,要用’↓ ’来标注”,就可以了。
6.关于有微溶反应物或产物的问题。从复分解反应的角度是很容易解决的。
当反应物都可溶、且浓度不很低(实验室中溶液浓度一般为0.1-1.0mol·L-1),产物端有微溶物质生成(如Ca(OH)2、CaSO4)时,反应都应该有自发进行的趋势。虽然这时阳离子或阴离子都沉淀的不见得会很完全(难达到被沉淀离子要小于10-5mol·L-1的分析化学要求的程度),但作为反应结果,应该可以明显地看到沉淀出现。所以,可以写出该反应的化学方程式。如
CaCl2+2NaOH= 2NaCl + Ca(OH)2↓,
CaCl2+Na2SO4= 2NaCl + CaSO4↓,都是合理的。
可以用计算来加以证明:Ca(OH)2的Ksp=4×10-6,CaSO4的Ksp=2×10-5。当0.1mol·L-1的相应反应物溶液等体积混合时,都会有沉淀生成。
另外,当反应物为微溶物质,产物为难溶物质时,反应当然也可以进行,并会进行的比较完全。
如反应“Ca(OH)2+NaCO3=CaCO3+2NaOH”。虽然按教材的规定,在“CaCO3”后不应该加符号“↓”。但这个反应也是能进行,且进行的相当完全。以至于在火碱较为昂贵的年代,就是用石灰乳与纯碱反应,来作为NaOH的一种工业制法。只是为了加快生产效率,还采用了加热及搅拌的措施。其实对这个反应在产物端的“CaCO3”后面加上符号“↓”,也没有什么不妥。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
在无机化学中,酸酐是酸脱水形成的,且绝大多数为氧化物,所...
硼酸是一种缺电子化合物,它与水作用时可通过配位键结合生成...
胶体的结构应该称作是双电层结构。 要认识胶体的结构,首先必...
在化学的研究与学习中,为简洁地表述某化学过程,常常要借助...
我们知道,早在1861年,英国科学家格雷厄姆(Thomas Graham)就提出...
纯净物都有固定不变的组成,这叫定组成定律,又叫定比定律。...