
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
角度一 常在气体摩尔体积的适用条件及物质的状态上设题
典 型 示 例
判 断 正 误
| (1)常温常压下,22.4 L Cl2中含有的分子数为6.02×1023个( ) (2)标准状况下,80 g SO3中含3NA个氧原子,体积约为22.4 L( ) (3)2·24 L CO2中含有的原子数为0.3NA( ) (4)标准状况下,4.48 L 重水(D2O)中含有的中子数为2NA (5)标准状况下,11.2 L 苯中含有的分子数目为0.5NA( ) (6)标准状况下,22.4 L 己烷中含己烷分子数目为NA (7)标准状况下,11.2 L N2O4与22.4 L NO2中所含的氧原子数均等于2Na( ) (8)标准状况下,22.4 L N2和O2的混合气体中含有的分子数为NA( ) (9)足量Zn与一定量的浓硫酸反应,产生22.4 L 气体时转移的电子数一定为2NA( ) (10)用惰性电极电解食盐水,若线路中通过Na电子的电量,则阳极产生气体11.2 L( ) 答案:(1)× (2)× (3)× (4)×(5)× (6)×(7)× (8)√ (9)× (10)× |
归纳点拨 | 一要看是否为标准状况下,不为标准状况无法直接用22.4 L·mol-1求n;二要看物质在标准状况下是否为气态,若不为气态也无法用22.4 L·mol-1求n,如CCl4、水、液溴、SO3、己烷、苯、HF等常作为命题的干扰因素迷惑学生 |
角度二 设置与计算无关的一些干扰条件
典 型 示 例
判 断 正 误
| (1)常温常压下,3.2 g O2所含的原子数为0.2NA( ) (2)标准状况下,18 g H2O所含的氧原子数目为NA( ) (3)常温常压下,40 g SO3中含2NA个原子( ) (4)常温常压下,92 g NO2和N2O4的混合气体中含有的原子总数为6NA( ) (5)常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA( ) 答案:(1)√ (2)√ (3)√ (4)√ (5)√ |
归纳点拨 | 给出非标准状况下气体的物质的量或质量,干扰学生正确判断,误以为无法求解物质所含的粒子数,实质上此时物质所含的粒子数与温度、压强等外界条件无关 |
角度三 常在物质的组成与结构上设题
典 型 示 例
判 断 正 误
| (1)7·8 g Na2O2中含有的阴离子数为0.1NA( ) (2)12 g NaHSO4晶体中阳离子和阴离子的总数为0.3NA( ) (3)78 g 苯中含有碳碳双键的数目为3NA( ) (4)7·5 g SiO2晶体中含有的硅氧键数为0.5NA( ) (5)将0.1 mol FeCl3溶于水中形成胶体后含有胶体粒子的数目为0.1NA( ) (6)18 g18O2中含有NA个氧原子( ) (7)1·8 g 重水(D2O)中含NA个中子( ) (8)丙烯和环丙烷组成的42 g 混合气体中氢原子的个数为6NA( ) (9)常温下,32 g 含有少量臭氧的氧气中,共含有氧原子2NA( ) (10)1·2 g 金刚石与石墨的混合物中含有碳碳单键的数目为0.4NA( ) 答案:(1)√ (2)× (3)× (4)√ (5)× (6)√ (7)× (8)√ (9)√(10)× |
归纳点拨 | (1)记住特殊物质中所含微粒(分子、原子、电子、质子、中子等)的数目,如Ne、D2O、18O2、O3、P4、H37Cl等。 (2)记住物质中所含化学键的数目,如SiO2、CO2、CnH2n+2等。 (3)记住最简式相同的物质中的微粒数目,如NO2和N2O4、乙烯和丙烯、O2和O3等。 (4)牢记物质的结构,如Na2O2是由Na+和O (5)掌握利用均摊法,突破晶体结构中共价键的计算。 |
角度四 常在难电离、易水解的粒子数目上设题
典 型 示 例
判 断 正 误
| (1)1 L 1 mol·L-1的Na2CO3溶液中含有NA个CO (2)1 L 0.5 mol·L-1CH3COOH溶液中,CH3COO-的个数为0.5NA( ) (3)0·1 mol·L-1的NaHSO4溶液中,阴、阳离子的数目之和为0.2NA( ) (4)等体积、等物质的量浓度的NaCl和KCl溶液中,阴、阳离子数目之和均为2NA( ) (5)25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA( ) (6)常温下,0.1 mol 碳酸钠晶体中含有CO (7)1·0 L 1.0 mol·L-1的NaAlO2水溶液中含有的氧原子数为2NA( ) (8)0·1 L 3.0 mol·L-1的NH4NO3溶液中含有的NH (9)常温下1 L pH=13的NaOH溶液中由水电离出的H+的数目为0.1NA( ) (10)25℃时,pH=3的醋酸溶液1 L,溶液中含H+的数目小于0.001NA( ) 答案:(1)× (2)× (3)× (4)× (5)× (6)√ (7)× (8)× (9) × (10) × |
归纳点拨 | 判断电解质溶液中粒子数目时注意“三看”:一看是否有弱电解质的电离;二看是否有弱离子的水解;三看是否指明了溶液的体积。弱电解质在水溶液中部分电离,可水解盐溶液中离子发生微弱水解,都会导致粒子数目减少 |
角度五 易在电子转移(得失)数目上设题
典 型 示 例
判 断 正 误
| (1)5·6 g 铁粉与硝酸反应失去的电子数一定为0.3NA( ) (2)1 mol Na与O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA( ) (3)1 mol Na2O2与足量CO2充分反应转移的电子数为2NA( ) (4)向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子数目为NA( ) (5)1 mol Cl2参加反应转移电子数一定为2NA( ) (6)H2O2分解制得标准状况下1.12 L O2,转移电子数目为0.2NA( ) (7)3 mol 单质Fe完全转变为Fe3O4,失去8NA个电子( ) (8)6·72 L NO2与水反应转移的电子数目为0.1NA( ) (9)2·8 g 铁粉与50 mL 4 mol·Lˉ1盐酸反应转移电子的数目为0.15NA( ) (10)1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA( ) 答案:(1)× (2)√ (3)× (4)× (5)× (6)× (7)√ (8)×(9)×(10)√ |
归纳点拨 | 电子转移(得失)数目的问题分析,要做到“三注意”:一要注意是否发生歧化反应,如Cl2与H2O、NaOH发生歧化反应时1 mol Cl2转移1 mol 电子,其他反应转移2 mol 电子;二要注意变价元素,如1 mol Fe与足量盐酸反应转移2 mol 电子,而与足量硝酸反应转移3 mol 电子;三要注意过量问题,如FeBr2溶液中通入少量Cl2与足量Cl2,转移的电子数是不一样的 |
角度六 易忽视一些特殊条件
典 型 示 例
判 断 正 误
| (1)标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA( ) (2)在密闭容器中加入1.5 mol H2和0.5 mol N2,充分反应后可得到NH3分子数为NA( ) (3) 7.8 g Na2S和Na2O2的混合物中,含有的阴离子数目为0.1NA( ) (4)2 mol SO2和1 mol O2在一定条件下充分反应后,混合物的分子数为2NA( ) (5)标准状况下,22.4 L NO2气体中所含分子数目为NA( ) (6)100 g 17%的氨水,溶液中含有的NH3分子数为NA( ) (7)50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA( ) (8)1·0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA( ) (9)密闭容器中1 mol PCl3与1 mol Cl2反应制备PCl5(g),增加2NA个P—Cl键( ) (10) 0.1 mol KI与0.1 mol FeCl3在溶液中反应转移的电子数为0.1NA( ) 答案:(1)× (2)× (3)√ (4)× (5)× (6)× (7)×(8)×(9)×(10)× |
归纳点拨 | 一要注意一些特殊的反应,如NO和O2不需要条件即可反应,NO2和N2O4之间存在相互转化,合成氨反应属于可逆反应;二要注意特殊的物质,如摩尔质量相同的物质:N2和CO、C2H4;Na2S和Na2O2;CaCO3与KHCO3;NaHCO3与MgCO3,摩尔质量成整数倍关系的物质:Cu2S和CuO;NO2与N2O4 |
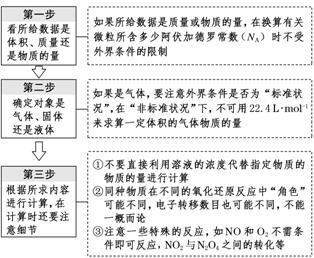
[规律方法] 解阿伏加德罗常数(NA)问题“三步骤”

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。陷阱1、物质的状态。 命题中常涉及物质的体积,需考虑是否为气体。 例如,标准状况下H...
类型一关于气体的摩尔体积 解题策略:有体积,无标况或非气态,均不能计算 注意:CCl ...
化学式子要配平,必须纯量代方程, 单位上下要统一,左右倍数要相等。 质量单位若用克...
1.化学方程式不正确就计算,这是最严重的问题. 2.把含杂质的质量直接应用在化学方程式...
有关阿伏伽德罗常数(N A )的计算是高考化学命题的一大热点,让考生对有关阿伏伽德罗...
一、高考定位 通过分析近几年的全国卷真题可知,该类试题多是通过阿伏加德罗常数将化...