
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
电极反应方程式的书写,尤其是复杂原电池电极方程式的书写,是高中化学教学的核心知识点,是高考化学命题的重点内容,那么如何书写复杂电池的电极反应方程式呢?
一、普通原电池,由活动性不同的两种金属或金属与非金属构成的原电池电极方程式的一般书写方法
(1)酸性条件下,金属失去电子在溶液中以离子态存在,碱性条件下,以氧化物或氢氧化物形式存在。
(2)负极:A(活泼金属)-ne-=An+或A(活泼金属)-ne-+nOH- =A(OH)n,或生成相应的氧化物,究竟生成物是什么,主要取决于总反应、电解质溶液的酸碱性、碱性条件下参加负极反应的金属失去电子后形成的阳离子能否与OH-共存。
(3)正极:Bm+(溶液中的氧化性强的阳离子)+me- =B
二、复杂及燃料电池电极方程式的书写规律
(1)电极方程式的书写中,如果是得到电子,相当于带负电,得多少个电子,相当于带多少个单位的负电荷,失去电子相当于带正电,失去多少个电子相当于带多少个单位的正电荷。
(2)酸性条件下:存在H+![]() H2O,既,酸性条件下,一般地若氢离子参加电极反应,则相应地生成水,若氢离子生成,则有水参加反应,有没有水的参加与生成,最终取决于电极应反左右的电荷守恒和原子守恒。
H2O,既,酸性条件下,一般地若氢离子参加电极反应,则相应地生成水,若氢离子生成,则有水参加反应,有没有水的参加与生成,最终取决于电极应反左右的电荷守恒和原子守恒。
(3)碱性条件下:存在OH-![]() H2O,意义同上。
H2O,意义同上。
(4)非水体系中,可根据熔融盐的阴、阳离子,确定电极反应两边的电荷守恒及原子守恒,一般地熔融盐中,阴离子参加电极反应或成为某一电极生成物。
(5)对于CxHyOz参加的负极反应,酸性条件下失电子后的产物均为CO2和H+,碱性条件下,失电子后的产物为CO32-和水。
三、复杂电极反应的书写步骤:
(1)先根据总反应确定正、负两极参加反应的物质,化合价升高、电子流出的极是原电池的负极,负极发生氧化反应;化合价降低、电子流入的极是原电池的正极,正极发生还原反应。
(2)先写负极的电极反应。根据总反应或以上总结的规律,确定负极的反应物及生成物
(3)根据负极反应物及对应的生成物的价态变化确定负极的摩尔得失电子数。
(4)根据离子反应两边电荷守恒,及溶液的酸碱性,用H+或OH-调整左右电荷守恒,再用水调整氢守恒,若是非水体系,既:熔融盐作电解质,则加相应的离子和物质调整电荷及元素守恒。
(5)正极的电极反应得电子,因为得电子是相当于带负电,再根据溶液的酸碱性,调整所加氢离子数或氢氧根数,最后用水调整元素守恒;或确定正极反应物与生成物再根据产物价态变化确定摩尔得失电子数,最后根据溶液的酸碱性确定电荷守恒和原子守恒。
例1:写出甲烷燃料电池(1)在酸性(H2SO4)条件下(2)碱性(NaOH)条件下的两极电极反应。已知总反应:CH4+2O2=CO2+2H2O
1、酸性条件下:
根据总反应,参加负极氧化反应的物质是CH4
第一步:根据总反应确定反应物和生成物:CH4→ CO2
第二步:根据前后价态变化确定摩尔得失电子数:CH4-8 e-→CO2
第三步:因为有了以上规律:失去电子相当于带正电,失去多少个电子相当于带多少个单位的正电荷,那么反应的左边带8个单位的负电荷,根据溶液酸性,只能在反应的右边加8个H+,左右电荷守恒CH4- 8 e- = CO2+8H+
第四步确定两边的氢原子守恒:CH4- 8 e-+2H2O=CO2+8H+
正极电极反应即使不知道产物,只要确定摩尔得失电子数及溶液的酸碱性就可知道在反应原左边还是右边加H+或OH-,进而调整原子守恒进行书写。
2、碱性条件
负极:(1)CH4 → CO32-(反应物、生成物)
(2)CH4-8 e- → CO32-(摩尔得失电子数)
(3)负极反应式:CH4+10OH--8 e-=CO32-+ 7H2O(电荷守恒和元素守恒)
3、非水体系
如总反应为CH4+2O2=CO2+2H2O构成的原电池,电解质为熔融K2CO3
负极电极反应为:(1)CH4 →CO2(反应物、生成物)
(2)CH4 -8 e-→CO2(摩尔得失电子数)
(3)CH4- 8 e-+4CO32-=5CO2+2H2O(根据反应物和生成物所含元素,只能用CO32-调整电荷守恒加水调整原子守恒)
正极电极反应为:O2+4 e-+2CO2=2CO32-
例2、2012年新课标卷:K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为
根据电极反应的书写规律,FeO42-是正极反应物,其还原产物是Fe3+,但因为是碱性条件下,故对应的产物为Fe(OH)3。
FeO42-→Fe(OH)3
摩尔得失电子为3,溶液显碱性
FeO42-+3 e-+4H2O=Fe(OH)3+5OH-
例3、银锌电池广泛用做各种电子仪器的电源,其电极分别是Ag2O和锌,电解液为KOH溶液。工作时原电池的总反应是:Ag2O+Zn+H2O===2Ag+Zn(OH)2,根据上述变化判断:
(1)原电池的正极是___________。
(2)工作时原电池两极反应式为:负极__________ ,正极__________ 。
(3)工作时原电池负极附近的pH值________(填“增大”、“不变”、“减小”)
解析:根据总反应和价态变化及溶液的酸碱性,负极是Zn,正极是Ag2O
负极反应:Zn-2e-+2OH-=Zn(OH)2
正极反应:Ag2O+2 e-+H2O=2Ag+2 OH-
以往老师们经常用总反应减去某一极的电极反应而得到另一电极反应,但学生对相当一部分电极反应的书写还是存在着很大的困难。而此法简单、快捷、准确,可应用于所有原电池与电解池的两极电极方程式的书写,电解池两极的电极反应,与书写电池电极反应规律完全相同。总体而言,只要知道电极反应的反应物和生成物,知道反应前后变价元素的总变价,则可知道得失电子数,再根据反应体系的酸碱性,若是非水体系,则可根据熔融电解质离子进行前后的电荷守恒及元素守恒,最后配平反应方程式。
以下几题,较为典型,通过练习能有较大的提升。
1、肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:
正极的电极反应式是 。负极的电极反应式是
2、甲醇燃料电池是最近摩托罗拉公司发明的一种由甲醇和氧气以及强碱作为电解质溶液的新型手机电池,电量是现有镍氢电池或锂电池的10倍。完成下列问题:写出正负极电极反应。
负极:
正极:
总反应式为:
3、有学者想以下图所示装置用原电池原理将SO2转化为重要的化工原料。
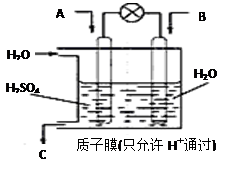
若A为SO2,B为O2,C为H2SO4,则负极反应式为 ,电池总反应式为 。
4、一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为![]() 。下列有关说法正确的是( )
。下列有关说法正确的是( )
A.检测室,电解质溶液中的![]() 向负极移动
向负极移动
B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
C.电池反应的化学方程式为:![]()
D.正极上发生的反应是:![]()
5、铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如下图所示:
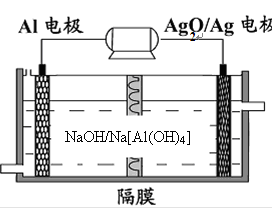
请写出该电池正极反应式
6、用气体传感器可以检测汽车尾气中CO的含量。传感器是以燃料电池为工作原理,其装置如右图所示,该电池中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是

A.负极的电极反应式为:COO2-![]() 2e-
2e- ![]() CO2
CO2
B.工作时电子由电极a通过传感器流向电极b
C.工作时电极b作正极,O2-由电极a流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
7、直接供氨式碱性燃料电池的电池反应式是4NH3+3O2=2N2+6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是 ,从理论上分析,该电池工作过程中 (填“需要”或“不需要”)补充KOH。
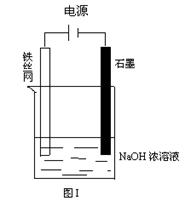
8、制备Na2FeO4较好的方法为电解法,其装置如图1所示。
①电解过程中阳极的电极反应式为____________。
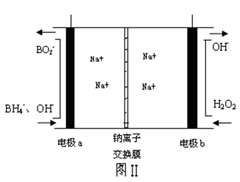
②图I装置中的电源采用NaBh4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电源工作原理如图II所示。工作过程中该电源的正极反应式为__________________
答案:
1、正极:O2+2H2O+4e-=4OH-
负极:4OH-+N2H4-4e-→N2+4H2O
2、负极:CH3OH + 8OH-- 6e-=CO32-+ 6H2O
正极:O2+2H2O + 4e-=4OH-
总反应:2 CH3OH+3 O2+4OH-=2 CO32-+6 H2O
3、负极:SO2+2H2O-2 e-=SO42-+4H+
总反应:2SO2+O2+2 H2O=2 SO42-+4H+
4、C
5、Ag2O+2e-+H2O=2Ag+2OH-
6、C
7、2NH3-6e-+6OH-===N2+6H2O 不需要
8、Fe+8OH--6e-=FeO42-+4H2O
H2O2+2e-=2OH-

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
锌溴液流电池是一种大规模储能电池,相比传统铅酸电池锂离子...
电化学是高中化学的重要组成部分,是高考的必考内容,然而,...
电化学原理是普通高中化学选择性必修1化学反应原理中的重要...
一、判断有机物得失电子 例1: 微生物电池是指在微生物的作用...
近几年全国卷高考电化学装置一般都带有离子交换膜,此类题目...
【 知识归纳 】 1. 浓差电池的定义 物质由 高浓度 向 低浓度 扩...