
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
常见分子的结构对比总结如下:
类型 | 分子式 | 中心原子VSEPR模型 | 中心原子杂化类型 | 中心原子孤电子对数目 | 分子或离 子构型 | 结构式 | 典型键角 | 化学键类型 | 分子极性 |
示例 | CO2 | 直线形 | sp | 0 | 直线形 | O=C=O | 180° | 非极性分子 | |
1︰1 型 | Cl2 | ★★★★★ | ★★★★★ | ★★★★★ | 直线形 | Cl-Cl | ★★★★★ | σ键 | 非极性分子 |
N2 | ★★★★★ | ★★★★★ | ★★★★★ | 直线形 | N≡N | ★★★★★ | σ键、π键 | 非极性分子 | |
HCl | ★★★★★ | ★★★★★ | ★★★★★ | 直线形 | H-Cl | ★★★★★ | σ键 | 极性分子 | |
IBr | ★★★★★ | ★★★★★ | ★★★★★ | 直线形 | I-Br | ★★★★★ | σ键 | 极性分子 | |
C2H2 | 直线形 | sp | ★★★★★ | 直线形 | H-C≡C-H | 180° | σ键、π键 | 非极性分子 | |
1:2 型 | H2O | 四面体 | sp3 | 2 | V形 |
| 104°30′ | σ键 | 极性分子 |
类型 | 分子式 | 中心原子VSEPR模型 | 中心原子杂化类型 | 中心原子孤电子对数目 | 分子或离 子构型 | 结构式 | 典型键角 | 化学键类型 | 分子极性 |
1:2 型 | BeCl2 | 直线形 | sp | 0 | 直线形 | Cl-Be-Cl | 180° | σ键 | 非极性分子 |
CS2 | 直线形 | sp | 0 | 直线形 | S=C=S | 180° | σ键、π键 | 非极性分子 | |
N2O | 直线形 | sp | 0 | 直线形 | N=N=O | 180° | σ键、π键 | 极性分子 | |
SO2 | 平面三角形 | sp2 | 1 | V形 |
| ★★★★★ | σ键、π键 | 极性分子 | |
NO2- | 平面三角形 | sp2 | 1 | V形 | ★★★★★ | ★★★★★ | σ键、π键 | ★★★★ | |
NH2- | 四面体 | sp3 | 2 | V形 | ★★★★★ | ★★★★★ | σ键 | ★★★★ | |
C2H4 | 平面三角形 | sp2 | 0 | 平面构型 |
| 约120° | σ键、π键 | 非极性分子 | |
1:3 型 | NH3 | 四面体 | sp3 | 1 | 三角锥形 |
| 107°18′ | σ键 | 极性分子 |
BF3 | 平面三角形 | sp2 | 0 | 平面三角形 | 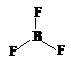 | 120° | σ键 | 非极性分子 | |
NF3 | 四面体 | sp3 | 1 | 三角锥形 |
| ★★★★★ | σ键 | 极性分子 | |
类型 | 分子式 | 中心原子VSEPR模型 | 中心原子杂化类型 | 中心原子孤电子对数目 | 分子或离 子构型 | 结构式 | 典型键角 | 化学键类型 | 分子极性 |
1:3 型 | PCl3 | 四面体 | sp3 | 1 | 三角锥形 |
| ★★★★★ | σ键 | 极性分子 |
SO3 | 平面三角形 | sp2 | 0 | 平面三角形 |
| 120° | σ键、π键 | 非极性分子 | |
C2H6 | 四面体 | sp3 | 0 | ★★★★★ | 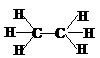 | 109°28′ | σ键 | 非极性分子 | |
CO32- | 平面三角形 | sp2 | 0 | 平面三角形 | ★★★★★ | 120° | σ键、π键 | ★★★★ | |
H3O+ | 四面体 | sp3 | 1 | 三角锥形 |
| ★★★★★ | σ键 | ★★★★ | |
1:4 型 | CH4 | 正四面体 | sp3 | 0 | 正四面体 |
| 109°28′ | σ键 | 非极性分子 |
CCl4 | 正四面体 | sp3 | 0 | 正四面体 | 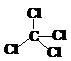 | 109°28′ | σ键 | 非极性分子 | |
SO42- | 正四面体 | sp3 | 0 | 正四面体 | ★★★★★ | 109°28′ | σ键 | ★★★★ | |
PO43- | 正四面体 | sp3 | 0 | 正四面体 | ★★★★★ | 109°28′ | σ键 | ★★★★ | |
ClO4- | 正四面体 | sp3 | 0 | 正四面体 | ★★★★★ | 109°28′ | σ键 | ★★★★ | |
类型 | 分子式 | 中心原子VSEPR模型 | 中心原子杂化类型 | 中心原子孤电子对数目 | 分子或离 子构型 | 结构式 | 典型键角 | 化学键类型 | 分子极性 |
1:4 型 | NH4+ | 正四面体 | sp3 | 0 | 正四面体 |
| 109°28′ | σ键 | ★★★★ |
BH4- | 正四面体 | sp3 | 0 | 正四面体 | 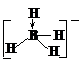 | 109°28′ | σ键 | ★★★★ | |
其它类型 | H2O2 | 四面体 | sp3 | 2 | ★★★★★ |
| ★★★★★ | σ键 | 极性分子 |
N2H4 | 四面体 | sp3 | 1 | ★★★★★ | 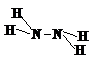 | ★★★★★ | σ键 | 极性分子 | |
HCN | 直线型 | sp | 0 | 直线型 | H-C≡N | 180° | σ键、π键 | 极性分子 | |
CH2O | 平面三角形 | sp2 | 0 | 平面三角形 |
| 约120° | σ键、π键 | 极性分子 | |
COCl2 | 平面三角形 | sp2 | 0 | 平面三角形 |
| ★★★★★ | σ键、π键 | 极性分子 | |
SOCl2 | 四面体 | sp3 | 1 | 三角锥形 |
| ★★★★★ | σ键、π键 | 极性分子 | |
PCl5 | 三角双锥 | ★★★★★ | 0 | 三角双锥 |
| ★★★★★ | σ键 | 非极性分子 | |
SF6 | 八面体 | ★★★★★ | 0 | 正八面体 |
| ★★★★★ | σ键 | 非极性分子 |

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
冠醚是一类大环多醚化合物,其分子结构呈环状,环上均匀分布...
在高考备考化学试卷里,经常会遇到含钯的催化剂。本文将就钯...
在离子晶体中存在离子极化现象,使得离子键带有一定共价键的...
【情境】:你注意到我们每天都离不开的水有什么反常之处吗?...
氢键的大小(强度)可以通过多种因素来比较,这些因素包括氢键...
...