
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
滴定分析法和重量分析法是化学分析中主要 的定量分析方法。重量分析法在以往的高考试题 中屡有出现,而滴定分析法则是近年高考试题的热点。常见的几种滴定类型如酸碱中和滴定、氧 化还原滴定、沉淀滴定、络合滴定在试卷中均有所 体现;常见的几种滴定方式如直接滴定法、返滴定 法、置换滴定法等在试题中亦均有体现。考察的内容主要有:指示剂的选择、滴定终点的判断,滴定操作的方法、步骤,仪器的选择,滴定数据的处理、计算以及滴定误差的分析等。
一、直接滴定法
直接滴定法就是直接采用标准溶液对试样溶液进行滴定。这是最常用和最基本的滴定方式, 简单、快速,引入的误差较小。
1.酸碱中和滴定
例1实验室常用MnO2与浓盐酸 反应制备cl2 (反应装置如图1所示)。
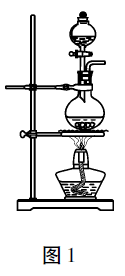
(1) 制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
A. 往烧瓶中加入MnO2粉末 B. 加热 C. 往烧瓶中加入浓盐酸
(2) 制备反应会因盐酸浓度下降而停止。为 测定反应残余液中盐酸的浓度,探究小组同学提 出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成 的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3 (过量)反应,称量 剩余的CaCO3质量。
丁方案:与足量Zn反应,测量生成的H2体积。
继而进行下列判断和实验:
①判定甲方案不可行,理由是 。
②进行乙方案实验:准确量取残余清液稀释 一定的倍数后作为试样。
a.量取试样20.00 mL,用0. 1000 mol • L-1 NaOH标准溶液滴定,消耗22.00 mL,该次滴定测得试样中盐酸浓度为____________mol • L-1 ;
b.平行滴定后获得实验结果。
③判断丙方案的实验结果 (填“偏大”、 “偏小”或“准确’):[已知:Ksp(CaCO3) =2.8×10-9、 Ksp (MnCO3) =2.3 ×10-11]
④进行丁方案实验:装置 如图2(夹持器具已略去)。
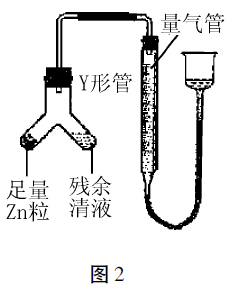
A. 使Y形管中的残余清 液与锌粒反应的正确操作是 将 转移到 中。
B. 反应完毕,每间隔1分 钟读取气体体积、气体体积逐 渐减小,直至不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)。
解析:
(1)加药顺序一般是先加入固体药品,再 加入液体药品,最后再加热。则依次顺序是ACB。
(2)①加入足量的硝酸银溶液只能求出氯离子的浓度,而不能求出剩余盐酸的浓度(因溶液中还有氯化锰)。
②由CHClVHCl = CNaOH VNaOH可得出盐酸 的浓度为0.1100 mol/L,这是简单的中和滴定计算。
③根据题意碳酸锰的Ksp比碳酸钙小,其中有部分碳 酸钙与锰离子反应转化成碳酸锰沉淀,而碳酸锰的相对分子质量较碳酸钙大,因而称量剩余的固体质 量会偏大,据此计算反应的碳酸钙固体减少,消耗的盐酸随之偏小,实验结果偏小。
④使Zn粒进入残余 清液中让其发生反应,这样残余清液就可以充分反 应;如果反过来,残余清液不可能全部转移到左边。 反应完毕时,相同时间内则气体体积减少,又排除了 其它影响因素,只能从气体本身角度思考,联想到该 反应是放热的,就可能想到气体未冷却了。
该实验题总体比较基础简单,主要考察化学 实验基础知识。其中第(2)问的②实验采用直接滴定法进行滴定,考察酸碱中和滴定的简单数据 处理、计算。
答案:(1) AcB;( 2)①残余清液中,c(Cl-)>c(H+);②0.1100;③偏小;④a. Zn粒残余清液(按 顺序写出两项),b.装置内气体尚未冷却至室温。
2.氧化还原滴定
例2亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常1 kg 样品中含SO2 的质量计),某研究小组设计了以下两种实验流程:
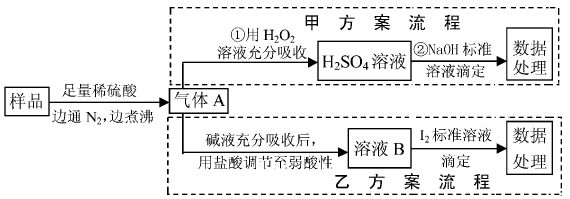
(1)气体A的主要成分是 ,为防止煮沸时发生暴沸,必须先向烧瓶中加入 ;通入N2 的目的是 。
(2)写出甲方案第①步反应的 离子方程式:
(3)甲方案第②步滴定前,滴 定管需用NaOH标准溶液润洗,其操作方法是 。
(4)若用盐酸代替稀硫酸处理样品,则按 乙方案实验测定的结果 (填“偏高”、“偏 低”或“无影响”。
(5)若取样品W g,按乙方案测得消耗0.01000 mol I2溶液V ml,则1 kg样品中含SO2的质量是 g(用含w、V的代数式表示)。
解析:
(1)样品中亚硫酸盐与稀硫酸作用生 成SO2 ,通入N2可将生成的全部赶出,因此气体A的主要成分为SO2、N2;为防止暴沸,可向烧 瓶中加入沸石或碎瓷片。
(2) SO2可被氧 化得到H2SO4,因此反应的离子方程式是SO2 + H2O2= SO42- +2H+。
(3)润洗滴定管的方法 是:向滴定管注入少量待装液体,倾斜转动滴定 管,使待装液体浸过滴定管全部内壁,然后从滴定 管尖嘴放出液体,重复操作2次〜3次。
(4)若用 盐酸代替硫酸,不会影响SO2的吸收,对测定结果无影响。
(5)在方案乙中用I2滴定的过程中发生的反应为:SO2 + I2 + 2H2O =SO42-+ 4H+ + 2I-。根据滴定过程中I2的用量可知W g 样品中m(SO2) =6.4×10-4 V g。故1 kg 样品中含有的质量 为 6.4 ×10-4 V g ÷ W g × 1000 g=0.64V/W g。
本题第(3)问考察滴定管的润洗方法,意在 考察学生是否真的做过实验,从而引导学生真正 动手做实验,而不是单纯听老师讲实验或看老师 在黑板上画实验,对中学教学有很好的指导作用。
本题第(5)问实验采用直接滴定法进行滴定 分析,考察了氧化还原滴定的数据处理、计算。
答案:(1)SO2和N2 碎瓷片(或沸石) 将生成的SO2全部赶出。(2)SO2 + I2 + 2H2O =SO42-+ 4H+ + 2I-。(3)在碱式滴定管中加入1mL〜2mL 标 准NaOH溶液,倾斜转动滴定管,让NaOH溶液浸 过滴定管内壁,然后从滴定管尖嘴放出液体,重复 操作2次〜3次。(4)无影响。(5) 0.64V/W。
3.沉淀滴定
例3氯化钾样品中含有少量碳酸钾、硫酸 钾和不溶于水的杂质。为了提纯氯化钾,先将样 品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。
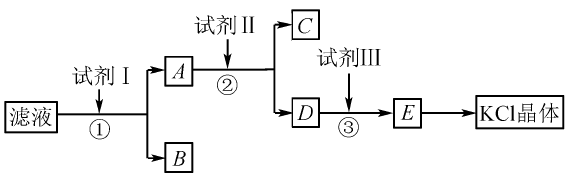
回答下列问题:(1)起始滤液的pH_________ 7 (填“大于,、“小于”或“等于”),其原因是 。
(2)试 剂I的化学式为 ,①中发生反应的离子方程式为 。
⑶试剂Ⅱ的化学式为) ,②中加入试剂Ⅱ 的目的是 。
⑷试剂Ⅲ的名称是 ,③中发生 反应的离子方程式为 。
(5)某同学称取提纯的 产品0.7759 g,溶解后定容在100 mL 容量瓶中,每次 取25.00 mL 溶液,用0.1000 mol • L-1的硝酸银标准 溶液滴定,三次滴定消耗标准溶液的平均体积为25.62 mL,该产品的纯度为_____ 。(列式并计算)
解析:
(1)起始滤液中含有碳酸钾,碳酸根 水解呈碱性,故溶液的pH大于7 ;
(2)要除掉杂质 离子硫酸根和碳酸根,应加入过量的钡离子如氯 化钡;
(3)要除掉多余的钡离子,要加入碳酸钾;
(4) 要除掉多余的碳酸根,要滴加适量的盐酸;
(5) 计算样品的纯度:根据Cl-+ Ag+ =AgCl, 由滴定时Ag+的消耗量求算出Cl -的量,进而求 出KCl的质量,再求该产品的纯度。计算时应注意0. 7759 g 样品配成100 mL 溶液,每次只取25 mL。
本题第(5)问考察了用沉淀法直接滴定的简 单计算。
答案:(1)大于 碳酸根离子水解呈碱性
(2) BaCl2 Ba2++ SO42- =BaSO4 Ba2++CO32- =BaCO3
(3) K2CO3除去多余的钡离子
(4) 盐酸 2H++CO32-=H2O + CO2
(5)0·02562 L ×0·1000 mol • L-1 ×74·5 g • mol-1 ×4/0. 7759 g =0.9840 ×100% =98.40%
二、返滴定法
返滴定法就是先加入一定量且过量的标准溶 液,待其与被测物质完全反应后再用另一种滴定 剂滴定剩余的标准溶液,从而计算被测物质的量, 因而返滴定法又称为剩余量滴定法。若滴定反应 速率缓慢,滴定固体物质反应不能立即完成或者 没有合适的指示剂时,可采用返滴定法进行滴定。
例4 (2011年福建理综化学部分23 - I )
I. 磷、硫元素的单质和化合物应用广泛。
(1) 磷元素的原子结构示意图 是 。
(2) 磷酸钙与焦炭、石英砂混合,在电炉中加 热到1500°C生成白磷,反应为:
2Ca3 (PO4) 2 +6SiO2 ==6CaSiO3 +P4O10
10C +P4O10 ==P4 +10CO
每生成1 mol P4时,就有_______ mol 电子发生转移。
(3 )硫代硫酸钠(Na2S2O3)是常用的还原剂。 在维生素C(化学式C6H8O6)的水溶液中加入过 量I2溶液,使维生素C完全氧化,剩余的I2用 Na2S2SO3溶液滴定,可测定溶液中维生素C的含 量。发生的反应为:
C6H8O6+I2 ==C6H6O6+2H+ +2I- 2S2O32-+I2 ==S4O62- +2I -
在一定体积的某维生素C溶液中加入a mol • L-1 I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定 剩余的I2,消耗b mol • L -1 Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是_________ mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸 钠可发生如下反应:2IO3- +5SO32- +2H + ==I2 +5SO42- +H2O
生成的碘可以用淀粉溶液检验,根据反应溶 液出现蓝色所需的时间来衡量该反应的速率。某 同学设计实验如下表所示:

实验目的 ;表中V2=
解析: (1) P原子的结构示意图略
(2)每生成1 molP4时,P由+5价变成0价,电子转移为5 ×4 =20或C化合价由0价变 成为+2价,电子转移为2 ×10 =20;
(3)已知用 Na2S2O3溶液滴定剩余的I2时,消耗n(Na2S2O3)=bV2/1000 mol;与其反应的I2为bV2/2000mol,在维生素C中共加入I2 aV1/1000 molmol,则与维生素C反应的I2为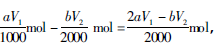 即维生素C的物质的量为
即维生素C的物质的量为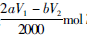
(4)由实验2可以看出混合液的总体积为50 mL, V1为10 mL, V2为40 mL, 实验1和实验2可知,实验目的是探究该反应速 率与亚硫酸钠溶液浓度的关系;实验2和实验3 可知,实验目的是探究该反应速率与温度的关系。
本题第(3)问采用返滴定法进行滴定分析, 考察氧化还原滴定中返滴定法的数据处理、计算。
三、置换滴定法
置换滴定法是先加入适当的试剂与待测组分定量反应,生成另一种可滴定的物质,再利用标准溶液 滴定反应产物,然后由滴定剂的消耗量,反应生成的物质与待测组分等物质的量的关系计算出待测组分 的含量。
这种滴定方式主要用于因滴定反应没有定量 关系或伴有副反应而无法直接滴定的测定。例 如,用K2Cr2O7标定Na2S2O3溶液的浓度时,就是 以一定量的K2Cr2O7在酸性溶液中与过量的KI 作用,析出相当量的I2,以淀粉为指示剂,用Na2S2O3 溶液滴定析出的I2,进而求得Na2SO3溶液的浓度。
例题略。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
双指示剂法是一种利用两种具有不同变色范围的酸碱指示剂,在...
弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常...
...