
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
人的认识是从感性的直观开始到理性的抽象才能反映客观事物本质的规律性。要反映事物本质的规律性,认识必须超出感性的直观世界,形成相对独立的主观精神世 界。这种超越要依靠一种抽象化的能够分开主体与客体的中介物,这个中介物就是模型。在通常情况下,模型分为物质模型和思想模型,我们把符号、图形等这种特 殊形式的模型看作为思想模型的一种。
比较溶液中分子、离子浓度大小是高考化学的热点考题,也是很多考生最常见的失分点之一。不少同学视此类问题为畏途,其根本原因在于不能建立起思维模型,不 能将溶液中微观的抽象的电离、水解等平衡关系形象化、具体化,解题时毫无章法、一团乱麻,其结果自然是解题速度慢且准确率低。教学中,笔者通过引导学生建 立电离、水解的关系模型,采用图形与数字相结合的方法,将溶液中抽象的电离、水解的关系图像化、数字化,从而游刃有余地解答此类试题。学生反映这种方法易 懂好用,特推荐给同行。
一.溶液中电离、水解模型的建立
基于模型思想解决离子浓度大小的问题,首先要建立一个基本模型(因为仅仅是模型,不必过于苛求电离、水解平衡中的真实数值)。
模型1.弱酸、弱碱的电离程度很小,数量级只有约1%;
模型2.盐的水解程度很小,数量级只有约1%;
模型3.等浓度的一元弱酸及其正盐共存于溶液中时,酸的电离程度更大还是盐的水解程度更大,取决于酸的强度。一般来说,若酸 的酸性比碳酸强(即酸的电离度大于碳酸第一元电离度),则酸的电离程度大于对应的盐的水解程度;反之,则盐的水解程度大于对应酸的电离程度。常见的电离程 度比碳酸强的酸、碱:HCOOH、CH3COOH、NH3·H2O、HSO3−,常见的电离程度比碳酸弱的酸:HClO、H2S、HCN、HCO3−。
模型4.三个守恒:
电荷守恒:如NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3−)+2c(CO32−)+c(OH−);
物料守恒:如NaHCO3溶液中n(Na+) : n(C)=1 : 1,推出:c(Na+)=c(HCO3−)+c(CO32−)+c(H2CO3);
质子守恒:例如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH−、CO32−为失去质子后的产物,故有以下关系:c(H3O+)+c(H2CO3)=c(NH3)+c(OH-)+c(CO32−)。
在某些选项中所列的等式如果既不像电荷守恒也不像物料守恒,则可能是两个守恒式相加减得来的。如在NaHCO3溶液中,等式c(H2CO3)+c(H+)=c(CO32−)+c(OH−)实际上是NaHCO3溶液中电荷守恒等式①减去物料守恒等式②得来的。
等式①
等式②
二.基于模型思想的图形与数字相结合解题实例
1.单一溶液离子浓度比较:
例1.在0.1mol/L的CH3COOH溶液中,下列关系正确的是
A.c(CH3COOH) > c(H+) > c(CH3COO−) > c(OH−)
B.c(CH3COOH) > c(CH3COO−) > c(H+) > c(OH−)
C.c(CH3COOH) > c(CH3COO−) = c(H+) > c(OH−)
D.c(CH3COOH) > c(CH3COO−) > c(OH−) >c(H+)
解析:如图1,假设CH3COOH分子有100 mol,其中有1.5 mol CH3COOH分子发生电离(见模型1),剩余CH3COOH分子为100 mol − 1.5 mol=98.5 mol,产生CH3COO-和H+均为1.5 mol,但由于要考虑水自身电离的H+,故H+浓度比CH3COO−浓度大;溶液呈酸性,OH−浓度极小,故CH3COO−浓度大于OH−。本题答案应选A。
例2.(2010广东理综)HA为酸性略强于醋酸的一元弱酸,在0.1 mol·L−1NaA溶液中,离子浓度关系正确的是
A.c(Na+) > c(A−)
> c(H+) >
c(OH−)
C.c(Na+) + c(OH−)
=
解析:如图2,假设100 mol NaA,其中水解了1.5 mol A−(见模型2),产生HA和OH−各为1.5 mol,剩余的A−为100-1.5=98.5(mol),Na+为100mol,水解后溶液呈碱性c(OH−) > c(H+),故A、B均错误。D符合电荷守恒(见模型4),D正确则C错误。本题答案应选D。
例3.在0.1 mol·L-1的NaHCO3溶液中,下列关系式正确的是
A.c(Na+) > c(HCO3-) > c(H+) > c(OH−)
B.c(Na+)+c(H+) = c(HCO3−)+c(OH−)+2 c(CO32−)
C.c(Na+) = c(HCO3−) > c(OH−) >c(H+)
D.c(Na+) = c(HCO3−) + c(H2CO3) +2c(CO32−)
解析:如图3,假设100 mol NaHCO3,则Na+为100 mol;因NaHCO3水溶液呈碱性,故HCO3−水解生成H2CO3的程度大于HCO3−电离生成CO32−的程度(见模型3),假设有1.5 mol HCO3−水解生成1.5 mol H2CO3和1.5 mol OH−,有1 mol HCO3−电离生成1 mol CO32−和1 mol H+,因此HCO3−剩余100-1.5-1=97.5(mol);考虑OH−中和了HCO3−电离产生的1 mol H+,则剩余OH−为1.5-1= 0.5(mol);溶液呈碱性,c(OH−)>c(H+),故A、C错误;选项D若考虑物料守恒(见模型4),则c(CO32−)系数应为1,故D错误;B符合电荷守恒(见模型4),故B正确。
2.混合溶液离子浓度比较
例4.将0.2 mol·L-1CH3COOK 与0.1 mol·L-1盐酸等体积混合后,则溶液中下列微粒的物质的量浓度的关系正确的是
A.c(CH3COO−) = c(Cl−) = c(H+) > c(CH3COOH)
B.c(CH3COO−) = c(Cl−) > c(CH3COOH) > c(H+)
C.c(CH3COO−) > c(Cl−) > c(H+) > c(CH3COOH)
D.c(CH3COO−) > c(Cl−) > c(CH3COOH) > c(H+)
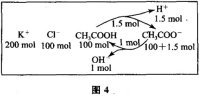
解析:0.2 mol·L−1CH3COOK 与0.1
mol·L−1盐酸等体积混合后,混合液为等浓度的CH3COOK、CH3COOH、KCl。如图4,CH3COOH是比等浓度的H2CO3更强的酸,故CH3COOH的电离程度比等浓度的CH3COO−的水解程度大,溶液呈酸性(见模型3)。假设CH3COOK、CH3COOH、KCl均为100mol,CH3COOH电离1.5mol,生成CH3COO−和H+各为1.5mol;CH3COO−水解了1mol,生成CH3COOH和OH−各1mol,最后CH3COO−为100+1.5-1=100.5(mol),Cl−为100mol,CH3COOH
为100-1.5+1=99.5(mol),剩余H+为1.5-1=0.5mol,故应选D。
3. 综合训练
例5.(2011江苏高考)下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A. 在0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
B. 在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-) + 2c(H2CO3-)
C. 向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:
c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
D. 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]:
c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
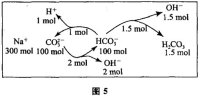
解析:A选项,见例3解析,在0.1
mol·L-1NaHCO3溶液中,HCO3-在溶液中存在水解与电离两个过程,而溶液呈碱性,说明水解过程大于电离过程(见模型3),有c(H2CO3)>c(CO32-);B选项,c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3-)中把c(H+)移项到等式另一边,即是质子守恒关系式(见模型4);C选项,向0.2
mol·L-1NaHCO3溶液中加入等体积0.1
mol·L-1NaOH溶液后,相当于0.05
mol·L-1的Na2CO3溶液和NaHCO3溶液的混合液,由于HCO3-的电离程度小于H2CO3的一级电离程度,故Na2CO3的水解程度大于NaHCO3的电离程度和水解程度(见模型3),如图5,假设Na2CO3和NaHCO3各100
mol,HCO3-为100-1-1.5+2=99.5(mol),CO32-为100-2+1=99(mol),OH-为1.5+2-1=2.5(mol),溶液呈碱性,c(OH-)>c(H+),因此正确的关系是:c(HCO3-)>c(CO32-)>c(OH-)>c(H+);D选项,常温下,CH3COONa和CH3COOH混合溶液,包括CH3COO-水解和CH3COOH电离两个过程,既然pH=7,
根据电荷守恒(模型4),不难得出c(Na+)=c(CH3COO-)=0.1
mol·
L-1,c(H+)=c(OH-)=1×10-7mol·L-1。CH3COO-水解程度很小(见模型2),故c(CH3COO-)>c(CH3COOH)。正确答案为B、D。
(本文发表于北京师范大学《高中数理化》2012年第2期下)

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
双指示剂法是一种利用两种具有不同变色范围的酸碱指示剂,在...
弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常...
...