
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
各离子放电情况分析表
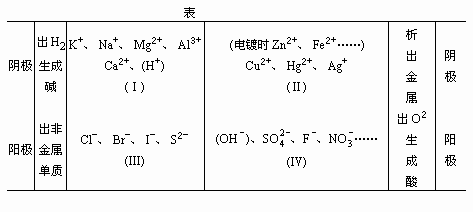
1.各类电解质溶液的电解情况分析
若溶液中阳离子仅有(Ⅰ)中或类似的离子,则通电后逸出H2,生成对应碱。
若溶液中阳离子只要有(Ⅱ)的离子,则通电后析出金属单质。
若溶液中阴离子只要有(Ⅲ)的离子,则通电后析出非金属单质。
若溶液中阴离子只有(Ⅳ)的离子,则通电后逸出O2生成对应酸。
例如:
(Ⅰ)—(Ⅲ)的溶液:NaCl、HCl
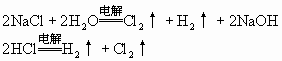
(Ⅰ)—(Ⅳ)的溶液:Na2SO4、H2SO4相当于电解水
![]()
(Ⅱ)—(Ⅲ)的溶液:CuCl2
![]()
(Ⅱ)—(Ⅳ)的溶液:AgNO3
![]()
2.电解后溶液如何恢复到原来的浓度和体积
由上述附表可看出应当“出啥加啥”,但应注意加入阴、阳两极的逸出物质的对应化合物,例如:
上述各物质的电解情况,若恢复原状况
NaCl、HCl——应加HCl气体
Na2SO4、H2SO4——应加水
CuCl2——应加CuCl2
AgNO3——应加Ag2O
3.电解过程溶液的pH变化
能引起电解过程中溶液pH变化的是由于H+、OH-的放电,打破了水的电离平衡引起的,因而表中:
(Ⅱ)—(Ⅲ)化合物溶液电解时阴、阳离子均放电,溶液pH几乎不变。
(Ⅰ)—(Ⅲ)的化合物溶液有两种类型NaCl、HCl,但结果H+放电,[OH-]增大,pH增大。
(Ⅱ)—(Ⅲ)的化合物溶液类似AgNO3、CuSO4……,电解时由于OH-放电,[H+]增大,pH减小。
(Ⅰ)—(Ⅳ)的化合物,不论什么情况都相当于电解水,但对于H2SO4、HNO3……由于电解水使溶液浓度升高,pH减小。
对于NaOH、KOH电解水,使溶液浓度升高,pH增大。
对于NaNO3、K2SO4电解水,使溶液浓度升高,但仍为中性。
4.电极区域溶液加入指示剂后颜色的变化
只有电解盐溶液,才能在电极区附近溶液观察到指示剂颜色的变化,电解酸、碱溶液一般观察不到。则由上述附表可看出:
只有(Ⅰ)中阳离子的溶液的阴极区,H+放电,打破了水的电离平衡,[OH-]增大,指示剂呈碱性条件下的颜色。
只有(Ⅳ)中阴离子的溶液的阳极区,OH-放电,[H+]增大,指示剂呈酸性条件下的颜色。
还要注意到若有Cl2逸出时有漂白作用。
5.活泼电极和特殊酸根
金属如:Cu、Fe、Ag、Zn……作阳极时,由于自身失电子能力强从而电极被腐蚀而进入溶液,这也是电镀的知识基础。

6.有关电解过程的计算
原则:整个电路中通过的电量(即电子总数)相等,则存在物质的量的相当量关系:
![]()

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。电化学是高中化学的重要组成部分,是高考的必考内容,然而,电解原理是电化学的重要理...
电化学原理是普通高中化学选择性必修1化学反应原理中的重要组成部分,也是高考化学中...
一、判断有机物得失电子 例1: 微生物电池是指在微生物的作用下将化学能转化为电能的...
近几年全国卷高考电化学装置一般都带有离子交换膜,此类题目新颖度高,学生因理不清交...
【 知识归纳 】 1. 浓差电池的定义 物质由 高浓度 向 低浓度 扩散而引发的一类电池称...
锌溴液流电池是一种大规模储能电池,相比传统铅酸电池锂离子电池等,把电解质存放在容...